2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
8. 反应C(s)+H₂O(g)⇌CO(g)+H₂(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(
A.降低温度
B.将容器的容积缩小一半
C.保持容积不变,充入N₂使体系压强增大
D.保持压强不变,充入N₂使容器容积变大
C
)A.降低温度
B.将容器的容积缩小一半
C.保持容积不变,充入N₂使体系压强增大
D.保持压强不变,充入N₂使容器容积变大
答案:
8.C【解析】降低温度,反应速率减小,A错误;将容器的容积缩小一半,反应物浓度变大,反应速率增大,B错误;保持容积不变,充入N₂使体系压强增大,反应物的浓度不变,对反应速率几乎没有影响,C正确;保持压强不变,充入N₂使容器容积变大,反应物浓度变小,反应速率减小,D错误。
9. [河南濮阳2024高一月考]反应aA(g)+bB(g)⇌cC(g)在容积和温度恒定的容器中进行,在某一分钟内测得:A减少0.15mol·L⁻¹,B减少0.05mol·L⁻¹,C增加0.1mol·L⁻¹,则下列叙述正确的是(
A.随着反应的进行,体系的压强逐渐增大
B.化学计量数之比a:b:c=3:1:2
C.单位时间内反应物浓度的减少量等于生成物浓度的增加量
D.若在前10s内A减少了xmol,则在前20s内A减少了2xmol
B
)A.随着反应的进行,体系的压强逐渐增大
B.化学计量数之比a:b:c=3:1:2
C.单位时间内反应物浓度的减少量等于生成物浓度的增加量
D.若在前10s内A减少了xmol,则在前20s内A减少了2xmol
答案:
9.B【解析】随着反应的进行,气体的总物质的量浓度逐渐减小,在容器容积和温度不变的条件下,气体物质的量减小,体系的压强逐渐减小,A错误;各物质浓度变化量之比等于化学计量数之比,则a:b:c=0.15:0.05:0.1=3:1:2,B正确;由题干信息可知,单位时间内反应物浓度的减少量与生成物浓度的增加量不相等,C错误;第2个10s内的反应速率比前10s内小,故第2个10s内减少的A的物质的量小于xmol,前20s内减少的A的物质的量小于2xmol,D错误。
10. [湖南娄底2025高一期中]在某温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是(
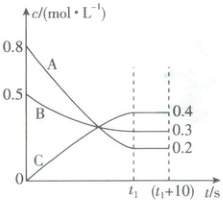
A.该反应的化学方程式为A(g)+3B(g)⇌2C(g)
B.t₁s时该反应已停止
C.恒温恒容条件下充入氩气,使容器压强增大,则反应速率不变
D.t₁s时,反应物A的转化率为25%
C
)
A.该反应的化学方程式为A(g)+3B(g)⇌2C(g)
B.t₁s时该反应已停止
C.恒温恒容条件下充入氩气,使容器压强增大,则反应速率不变
D.t₁s时,反应物A的转化率为25%
答案:
10.C【解析】0~t₁s,A的浓度减小了0.8mol·L⁻¹-0.2mol·L⁻¹=0.6mol·L⁻¹,B的浓度减小了0.5mol·L⁻¹-0.3mol·L⁻¹=0.2mol·L⁻¹,C的浓度增大了0.4mol·L⁻¹,根据各物质浓度变化量之比等于化学计量数之比,可得该反应的化学方程式为3A(g)+B(g)⇌2C(g),A错误;t₁s时,反应达到平衡状态,正、逆反应速率相等且不为0,反应并没有停止,是动态平衡,B错误;恒温恒容条件下充入氩气,使容器压强增大,但是反应物和产物浓度不变,则反应速率不变,C正确;设反应容器容积为VL,由图可知,t₁s时,反应物A的转化率$=\frac{(0.8-0.2)Vmol}{0.8Vmol}×100\%=75\%,$D错误。
归纳总结反应体系中充入气体对反应速率的影响,主要取决于对反应物的浓度的影响,而对反应物浓度的影响主要取决于容器容积和反应物的物质的量的变化。
(1)恒温、恒容条件下充入反应物(气体),反应容器容积不变,反应物的物质的量增大,则反应物浓度增大,反应速率增大。
(2)恒温、恒容条件下充入与反应无关的气体,反应容器容积不变,反应物的物质的量不变,则反应物浓度不变,反应速率不变。
(3)恒温、恒压条件下充入与反应无关的气体,反应容器容积增大,反应物的物质的量不变,则反应物浓度减小,反应速率减小。
归纳总结反应体系中充入气体对反应速率的影响,主要取决于对反应物的浓度的影响,而对反应物浓度的影响主要取决于容器容积和反应物的物质的量的变化。
(1)恒温、恒容条件下充入反应物(气体),反应容器容积不变,反应物的物质的量增大,则反应物浓度增大,反应速率增大。
(2)恒温、恒容条件下充入与反应无关的气体,反应容器容积不变,反应物的物质的量不变,则反应物浓度不变,反应速率不变。
(3)恒温、恒压条件下充入与反应无关的气体,反应容器容积增大,反应物的物质的量不变,则反应物浓度减小,反应速率减小。
11. [安徽黄山2025高一期中]为了探究外界条件对H₂O₂分解反应速率的影响,某同学分别在三支试管中加入了相同体积的H₂O₂溶液,并测量收集VmL气体所需的时间,实验记录如下:
下列结论错误的是(
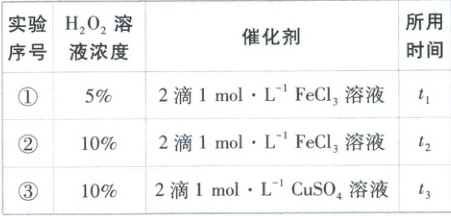
A.实验①②研究的是浓度对反应速率的影响
B.实验②③研究的是不同催化剂对反应速率的影响
C.若t₃>t₂,则说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好
D.若探究温度对反应速率的影响,该实验不宜过度加热
下列结论错误的是(
C
)
A.实验①②研究的是浓度对反应速率的影响
B.实验②③研究的是不同催化剂对反应速率的影响
C.若t₃>t₂,则说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好
D.若探究温度对反应速率的影响,该实验不宜过度加热
答案:
11.C【解析】实验①②中过氧化氢的浓度不同,其他因素相同,则其研究的是浓度对反应速率的影响,A正确;实验②③中过氧化氢浓度相同,②中加入的催化剂是氯化铁,③中加入的催化剂是硫酸铜,研究的是不同催化剂对反应速率的影响,B正确;实验②③中,两种催化剂的阳离子和阴离子均不同,若t₃>t₂,不能说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好,C错误;过度加热会导致较多的水蒸气混入气体中,影响气体体积的测定,D正确。
12. [江西萍乡2025高一期中]硫代硫酸钠(Na₂S₂O₃)是重要的还原剂,能被酸性KMnO₄溶液氧化,反应原理如下:5Na₂S₂O₃+8KMnO₄+7H₂SO₄=8MnSO₄+5Na₂SO₄+4K₂SO₄+7H₂O。某学习小组为探究影响该化学反应速率的因素,设计了如表所示系列实验。
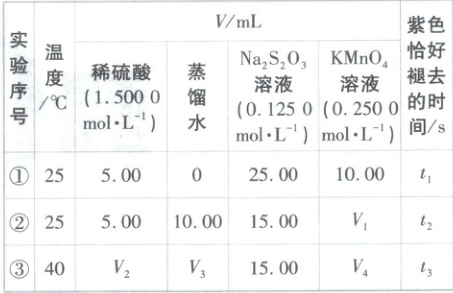
下列说法错误的是(
A.实验②和③探究温度对反应速率的影响,则需V₃=V₄=10.00
B.t₁<t₂,t₃<t₂
C.实验中除能观察到溶液紫色褪去外还能观察到溶液变浑浊
D.若实验①中,t₁=5s,则前5s内平均反应速率v(KMnO₄)=0.0500mol·L⁻¹·s⁻¹

下列说法错误的是(
D
)A.实验②和③探究温度对反应速率的影响,则需V₃=V₄=10.00
B.t₁<t₂,t₃<t₂
C.实验中除能观察到溶液紫色褪去外还能观察到溶液变浑浊
D.若实验①中,t₁=5s,则前5s内平均反应速率v(KMnO₄)=0.0500mol·L⁻¹·s⁻¹
答案:
12.D【解析】实验①和②的Na₂S₂O₃溶液体积不同,探究Na₂S₂O₃溶液浓度对该反应速率的影响,则其他条件应保持相同,溶液总体积为40.00mL,实验②中蒸馏水为10.00mL,则V₁=10.00;实验②和③温度不同,其他条件相同,即实验③中V₂=5.00、V₃=10.00,V₄=10.00,A正确。实验
KMnO₄物质的量为0.25×10⁻³mol=2.5×10⁻³mol,实验
②和③中硫酸物质的量为1.5×5×10⁻³mol=7.5×10⁻³mol,
硫代硫酸钠物质的量为0.125×15×10⁻³mol=1.875×
10⁻³mol,根据化学方程式5Na₂S₂O₃+8KMnO₄+7H₂SO₄══
8MnSO₄+5Na₂SO₄+4K₂SO₄+7H₂O,KMnO₄完全反应,
Na₂S₂O₃与H₂SO₄过量,酸性条件下,S₂O₃²⁻发生歧化反应
生成S和SO₂,因此实验中除能观察到溶液紫色褪去外还能
观察到溶液变浑浊,C正确。实验①中KMnO₄的初始浓度
为$\frac{0.25×10}{40}mol·L⁻¹=0.0625mol·L⁻¹($稀释后),初始至
完全反应时平均速率$v(KMnO₄)=\frac{0.0625}{5}mol·L⁻¹·s⁻¹=$
0.0125mol·L⁻¹·s⁻¹,D错误。
KMnO₄物质的量为0.25×10⁻³mol=2.5×10⁻³mol,实验
②和③中硫酸物质的量为1.5×5×10⁻³mol=7.5×10⁻³mol,
硫代硫酸钠物质的量为0.125×15×10⁻³mol=1.875×
10⁻³mol,根据化学方程式5Na₂S₂O₃+8KMnO₄+7H₂SO₄══
8MnSO₄+5Na₂SO₄+4K₂SO₄+7H₂O,KMnO₄完全反应,
Na₂S₂O₃与H₂SO₄过量,酸性条件下,S₂O₃²⁻发生歧化反应
生成S和SO₂,因此实验中除能观察到溶液紫色褪去外还能
观察到溶液变浑浊,C正确。实验①中KMnO₄的初始浓度
为$\frac{0.25×10}{40}mol·L⁻¹=0.0625mol·L⁻¹($稀释后),初始至
完全反应时平均速率$v(KMnO₄)=\frac{0.0625}{5}mol·L⁻¹·s⁻¹=$
0.0125mol·L⁻¹·s⁻¹,D错误。
查看更多完整答案,请扫码查看


