2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [四川绵阳2024高一月考]观察图:对合成氨反应,下列叙述错误的是(
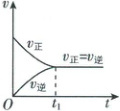
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达$t_{1}$时,正反应速率与逆反应速率相等,反应停止
D.反应在$t_{1}$之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
C
)
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达$t_{1}$时,正反应速率与逆反应速率相等,反应停止
D.反应在$t_{1}$之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
答案:
1.C
教材变式 本题是教材P49练习与应用第4题的变式题,综合考查了可逆反应的特点、正反应速率与逆反应速率的大小比较、化学平衡状态的判断。
【解析】反应开始时,反应物的浓度最大,正反应速率最大,生成物的浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物的浓度降低,则正反应速率逐渐减小,生成物的浓度增大,则逆反应速率逐渐增大,B正确;反应到达t₁时,正反应速率与逆反应速率相等,但都不为零,反应没有停止,C错误;反应在t₁之后,正反应速率与逆反应速率相等,反应达到化学平衡状态,D正确。
教材变式 本题是教材P49练习与应用第4题的变式题,综合考查了可逆反应的特点、正反应速率与逆反应速率的大小比较、化学平衡状态的判断。
【解析】反应开始时,反应物的浓度最大,正反应速率最大,生成物的浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物的浓度降低,则正反应速率逐渐减小,生成物的浓度增大,则逆反应速率逐渐增大,B正确;反应到达t₁时,正反应速率与逆反应速率相等,但都不为零,反应没有停止,C错误;反应在t₁之后,正反应速率与逆反应速率相等,反应达到化学平衡状态,D正确。
2. [安徽部分学校2025高一期中联考]下列过程与可逆反应无关的是(
A.高炉炼铁排放的尾气,随高炉的高度增加,${CO}$的比例不变
B.氯气溶于水,溶液中既存在${Cl^{-}}$也存在${Cl_{2}}$
C.铜和浓硫酸在加热条件下能反应,不加热不能反应
D.${SO_{2}}$和${O_{2}}$在接触室中反应生成${SO_{3}}$
C
)A.高炉炼铁排放的尾气,随高炉的高度增加,${CO}$的比例不变
B.氯气溶于水,溶液中既存在${Cl^{-}}$也存在${Cl_{2}}$
C.铜和浓硫酸在加热条件下能反应,不加热不能反应
D.${SO_{2}}$和${O_{2}}$在接触室中反应生成${SO_{3}}$
答案:
2.C 【解析】高炉炼铁的尾气中CO比例不变说明反应C+CO₂⇌2CO是可逆反应,A不符合题意;Cl₂溶于水存在可逆反应:Cl₂+H₂O⇌HClO+H⁺+Cl⁻,溶液中既存在Cl⁻也存在Cl₂,B不符合题意;铜与浓硫酸在加热时反应生成SO₂等产物,常温下不反应,与可逆反应无关,C符合题意;SO₂与O₂反应生成SO₃,是典型的可逆反应:2SO₂+O₂$\underset{\triangle}{\overset{催化剂}{⇌}}$2SO₃,D不符合题意。
3. 下列关于平衡状态和反应限度的说法正确的是(
A.一个可逆反应达到平衡状态后,这个反应在该条件下不再反应
B.当一个可逆反应达到平衡状态时,正、逆反应速率相等
C.平衡状态是一种静止的状态,反应物和生成物的浓度相等
D.化学反应的限度不可以通过改变条件而改变
B
)A.一个可逆反应达到平衡状态后,这个反应在该条件下不再反应
B.当一个可逆反应达到平衡状态时,正、逆反应速率相等
C.平衡状态是一种静止的状态,反应物和生成物的浓度相等
D.化学反应的限度不可以通过改变条件而改变
答案:
3.B 【解析】化学平衡是一个动态平衡,可逆反应在平衡状态时仍然继续进行反应,只不过正、逆反应速率相等,A错误,B正确;平衡状态是一种表面静止的状态,正、逆反应速率相等,各组分的浓度保持不变,但反应物和生成物的浓度不一定相等,C错误;化学反应的限度可以通过改变条件而改变,D错误。
4. [浙江杭州2025高一期中]在一定温度下,恒容的密闭容器中,可逆反应${X(g) + 3Y(g){<=>[][]}2Z(g)}$达到平衡的标志是(
A.气体总质量保持不变
B.${X}$、${Y}$、${Z}$的浓度都相等
C.容器内压强不再发生变化
D.${X}$、${Y}$、${Z}$的分子数之比为$1:3:2$
C
)A.气体总质量保持不变
B.${X}$、${Y}$、${Z}$的浓度都相等
C.容器内压强不再发生变化
D.${X}$、${Y}$、${Z}$的分子数之比为$1:3:2$
答案:
4.C 【解析】反应前后全是气体,气体总质量是恒量,气体总质量保持不变,反应不一定平衡,A不符合题意;X、Y、Z的浓度都相等,不能判断浓度是否还发生改变,反应不一定平衡,B不符合题意;该反应为反应前后气体分子数发生变化的反应,气体总物质的量是变量,压强是变量,容器内压强不再发生变化,反应一定达到平衡状态,C符合题意;X、Y、Z的分子数之比为1:3:2,不能判断各物质浓度是否还发生改变,反应不一定平衡,D不符合题意。
5. [天津部分学校2025高一期中]可逆反应${2NO_{2}(g)}$(红棕色)${{<=>[][]}2NO(g)}$(无色)${+O_{2}(g)}$,在容积固定的密闭容器中达到平衡状态的标志是(
①单位时间内生成$n\ {mol O_{2}}$的同时生成$2n\ {mol NO_{2}}$
②单位时间内生成$n\ {mol O_{2}}$的同时生成$2n\ {mol NO}$
③用${NO_{2}}$、${NO}$、${O_{2}}$表示的反应速率之比为$2:2:1$的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.①②③④⑤⑥⑦
A
)①单位时间内生成$n\ {mol O_{2}}$的同时生成$2n\ {mol NO_{2}}$
②单位时间内生成$n\ {mol O_{2}}$的同时生成$2n\ {mol NO}$
③用${NO_{2}}$、${NO}$、${O_{2}}$表示的反应速率之比为$2:2:1$的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.①②③④⑤⑥⑦
答案:
5.A 【解析】①单位时间内生成n mol O₂的同时生成2n mol NO₂,正、逆反应速率相等,说明反应已达到平衡状态。②生成O₂和生成NO都是正反应方向,单位时间内生成n mol O₂必生成2n mol NO,不能判断正、逆反应速率是否相等,不能说明反应达到平衡状态。③中无论达到平衡与否,用各物质表示的化学反应速率之比都等于化学计量数之比,所以NO₂、NO、O₂表示的反应速率之比为2:2:1的状态不一定是平衡状态。④NO₂为红棕色气体,其余为无色气体,混合气体的颜色不变,则表示NO₂的浓度不再变化,说明反应已达到平衡状态。⑤容器容积固定、反应前后气体质量守恒,气体密度始终不变,混合气体的密度不再改变不一定是平衡状态。⑥反应后气体的物质的量增大,压强是变量,压强不变,意味着各物质的含量不再变化,说明已达到平衡状态。⑦由于气体的质量不变,反应后气体分子数增多,平均相对分子质量减小,气体的平均相对分子质量不变,说明气体中各物质的物质的量不变,反应已达到平衡状态。①④⑥⑦达到平衡状态,选A。
归纳总结 反应达到化学平衡状态的标志
(1)直接标志:正反应速率等于逆反应速率。注意反应速率的方向必须包括正向和逆向,同时要注意用不同物质表示的反应速率之比等于化学方程式中相应物质的化学计量数之比。
(2)间接标志:体系中各组分的含量即物质的量浓度、物质的量分数、气体体积分数、质量分数等不变。
特定条件的标志:
①恒温恒容条件下,对于反应前后气体体积改变的反应,压强不变是平衡的标志;
②恒温恒容条件下,对于反应前后气体体积不改变的反应,压强不变不能作平衡的标志;
③恒温恒压条件下,对于反应前后气体体积改变的反应,气体密度不变是平衡的标志;
④恒温恒容条件下,对于有非气体物质参加的反应,气体密度不变是平衡的标志。
归纳总结 反应达到化学平衡状态的标志
(1)直接标志:正反应速率等于逆反应速率。注意反应速率的方向必须包括正向和逆向,同时要注意用不同物质表示的反应速率之比等于化学方程式中相应物质的化学计量数之比。
(2)间接标志:体系中各组分的含量即物质的量浓度、物质的量分数、气体体积分数、质量分数等不变。
特定条件的标志:
①恒温恒容条件下,对于反应前后气体体积改变的反应,压强不变是平衡的标志;
②恒温恒容条件下,对于反应前后气体体积不改变的反应,压强不变不能作平衡的标志;
③恒温恒压条件下,对于反应前后气体体积改变的反应,气体密度不变是平衡的标志;
④恒温恒容条件下,对于有非气体物质参加的反应,气体密度不变是平衡的标志。
6. [河南新乡2024高一期末]硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为${2SO_{2} + O_{2}{<=>[催化剂][\Delta ]}2SO_{3}}$。下列有关该反应的说法不正确的是(
A.${SO_{2}}$和${O_{2}}$不可能全部转化为${SO_{3}}$
B.反应达到平衡后,正、逆反应速率相等且均为$0$
C.该反应从开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.工业上生产${SO_{3}}$时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
B
)A.${SO_{2}}$和${O_{2}}$不可能全部转化为${SO_{3}}$
B.反应达到平衡后,正、逆反应速率相等且均为$0$
C.该反应从开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.工业上生产${SO_{3}}$时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
答案:
6.B 【解析】该反应为可逆反应,反应物的转化率<100%,故SO₂和O₂不可能全部转化为SO₃,A正确;反应达到平衡后,正、逆反应速率相等,化学平衡是一种动态平衡,反应速率不可能为0,B错误;该反应从开始到平衡的过程中,反应物浓度不断减小,生成物浓度不断增大,故正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等,达到平衡状态,C正确;工业上生产SO₃时,要考虑转化率及反应时间,即同时考虑反应所能达到的限度和化学反应速率两方面的问题,D正确。
7. [黑龙江绥化2025高一期末]对于可逆反应${4NH_{3} + 5O_{2}{<=>[][]}4NO + 6H_{2}O}$,下列叙述正确的是(
A.加入催化剂,可以加快反应速率并增大反应限度
B.保持容器内气体压强不变,向其中加入${He}$,化学反应速率不变
C.保持容器容积不变,向其中加入${He}$,化学反应速率增大
D.达到化学平衡时,$4v_{正}({O_{2}}) = 5v_{逆}({NO})$
D
)A.加入催化剂,可以加快反应速率并增大反应限度
B.保持容器内气体压强不变,向其中加入${He}$,化学反应速率不变
C.保持容器容积不变,向其中加入${He}$,化学反应速率增大
D.达到化学平衡时,$4v_{正}({O_{2}}) = 5v_{逆}({NO})$
答案:
7.D 【解析】催化剂能加快反应速率,但不能改变反应限度,A错误;恒压下,充入He,容器容积增大,反应物浓度降低,化学反应速率减小,B错误;恒容下,充入He,反应物浓度不变,化学反应速率不变,C错误;平衡时,正、逆反应速率之比等于化学计量数之比,则达到化学平衡时,4v正(O₂)=5v逆(NO),D正确。
查看更多完整答案,请扫码查看


