2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [河北示范高中 2025 高一联考]如图所示,氮循环是生物圈内的基本循环之一,研究氮的循环和转化对生产和生活有重要的价值。下列说法错误的是(

A.硝化和反硝化过程均为氧化还原反应,反硝化过程中,含氮物质发生还原反应
B.硝化过程需要有氧化剂参与,反硝化过程有利于氮的良性循环,维持生态平衡
C.氨态氮与亚硝态氮在氨氧化细菌的作用下转化为氮气的离子方程式:$NH_4^+ + NO_2^- \xlongequal{氨氧化细菌} N_2↑ + 2H_2O$,生成$1mol$ $N_2$转移的电子数为$3$
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
C
)
A.硝化和反硝化过程均为氧化还原反应,反硝化过程中,含氮物质发生还原反应
B.硝化过程需要有氧化剂参与,反硝化过程有利于氮的良性循环,维持生态平衡
C.氨态氮与亚硝态氮在氨氧化细菌的作用下转化为氮气的离子方程式:$NH_4^+ + NO_2^- \xlongequal{氨氧化细菌} N_2↑ + 2H_2O$,生成$1mol$ $N_2$转移的电子数为$3$
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
答案:
1.C [解析]硝化过程为NH₃、NH₄⁺→NO₂⁻、NO₃⁻,反硝化过程为NO₃⁻、NO₂⁻→N₂,均有化合价的变化,故均为氧化还原反应,反硝化过程中N元素的化合价由高价态变为低价态,化合价降低,被还原,故反硝化过程中含氮物质发生还原反应,A正确;硝化过程中,氮元素化合价升高,则硝化过程需要有氧化剂参与,反硝化过程中,向大气提供氮气,即反硝化过程利于氮良性循环,维持生态平衡,B正确;根据离子反应方程式NH₄⁺+NO₂⁻$\stackrel{氨氧化细菌}{→}$N₂↑+2H₂O,生成1molN₂转移3mol电子,数目为3Nₐ,C错误;动植物蛋白为有机物,NO₃⁻、NO₂⁻、NH₄⁺、NH₃为无机物,同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化,D正确。
2. 下列有关实验操作、现象和解释或结论都正确的是(

A.①②
B.③④
C.②③④
D.②④
D
)
A.①②
B.③④
C.②③④
D.②④
答案:
2.D [解析]过量的铁粉与稀硝酸反应生成Fe²⁺,再加入KSCN溶液,颜色不变,①错误;浓硝酸久置或光照变黄是HNO₃分解产生的NO₂溶于浓硝酸所致,②正确;常温下,Al箔遇浓硝酸钝化,稀硝酸会使Al箔溶解,③错误;浓硝酸具有酸性和强氧化性,可使蓝色石蕊试纸先变红后褪色,④正确。综上所述,选D。
3. 化合价和物质类别是学习元素及其化合物知识的两个要素,可表示为“价—类”二维图。氮元素的“价—类”二维图如图,下列说法正确的是(
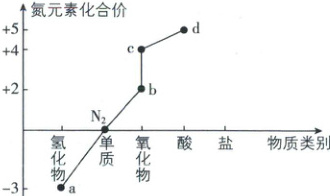
A.$a$与$b$均可用排空气法收集
B.$a$可以发生催化氧化生成$b$
C.$c$是酸性氧化物
D.铜和$d$的稀溶液反应,$d$只表现氧化性
B
)
A.$a$与$b$均可用排空气法收集
B.$a$可以发生催化氧化生成$b$
C.$c$是酸性氧化物
D.铜和$d$的稀溶液反应,$d$只表现氧化性
答案:
3.B [解析]a为氨气、b为一氧化氮、c为二氧化氮(或四氧化二氮)、d为硝酸。一氧化氮易与空气中的氧气反应生成二氧化氮,不能用排空气法收集,A错误;氨气具有还原性,加热、催化剂作用下氨气与氧气发生催化氧化反应生成一氧化氮和水,B正确;二氧化氮与水反应生成硝酸和一氧化氮,N由+4价变为+5价和+2价,不能生成+4价对应的含氧酸,所以二氧化氮不是酸性氧化物,C错误;铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应中氮元素的化合价部分降低被还原、部分不变形成硝酸铜,硝酸表现氧化性和酸性,D错误。
4. [山西忻州一中 2025 高一月考]取$11.2g$铜镁合金,恰好溶解在$100mL$某浓度的硝酸溶液中,生成$NO$和$NO_2$的混合气体$0.5mol$,向反应后溶液中逐滴滴加$NaOH$溶液,当溶液中金属阳离子全部沉淀,得到$21.4g$沉淀。下列说法不正确的是(
A.该合金中$m(Cu):m(Mg)=4:3$
B.原硝酸物质的量浓度为$1mol·L^{-1}$
C.硝酸在反应中既体现氧化性又体现酸性
D.生成的$NO$和$NO_2$混合气体能被$NaOH$完全吸收
B
)A.该合金中$m(Cu):m(Mg)=4:3$
B.原硝酸物质的量浓度为$1mol·L^{-1}$
C.硝酸在反应中既体现氧化性又体现酸性
D.生成的$NO$和$NO_2$混合气体能被$NaOH$完全吸收
答案:
4.B
思路导引:铜镁合金溶解于硝酸溶液中转化为Cu²⁺、Mg²⁺,向反应后溶液中逐滴滴加NaOH溶液,得到的21.4g沉淀为Cu(OH)₂、Mg(OH)₂,设铜镁合金中Cu、Mg的物质的量分别为xmol、ymol,则64x+24y=11.2①,98x+58y=21.4②,由①②解得x=0.1,y=0.2,即该合金中铜与镁的物质的量分别为0.1mol、0.2mol。
[解析]由分析可知,该合金中铜与镁的质量之比为$\frac{64g·mol⁻¹×0.1mol}{24g·mol⁻¹×0.2mol}$=$\frac{4}{3}$,A正确;由题意知,HNO₃与铜镁合金反应的产物为NO、NO₂、Cu(NO₃)₂、Mg(NO₃)₂,原硝酸的物质的量n(HNO₃)=2n(Mg²⁺)+2n(Cu²⁺)+n(NO)+n(NO₂)=2×0.2mol+2×0.1mol+0.5mol=1.1mol,则原硝酸物质的量浓度为11mol·L⁻¹,B错误;氮元素在反应中有一部分化合价降低得到NO和NO₂,还有一部分化合价未发生变化得到Cu(NO₃)₂、Mg(NO₃)₂,所以硝酸既体现氧化性又体现酸性,C正确;设生成的NO和NO₂的物质的量分别为amol、bmol,则a+b=0.5,根据得失电子守恒,3a+b=2×0.1+2×0.2,两式联立可得:a=0.05,b=0.45,由于NO+NO₂+2NaOH=2NaNO₂+H₂O、2NO₂+2NaOH=NaNO₂+NaNO₃+H₂O,当$\frac{n(NO₂)}{n(NO)}$≥1时,氮氧化物能被NaOH完全吸收,所以该反应过程中的氮氧化物能被完全吸收,D正确。
思路导引:铜镁合金溶解于硝酸溶液中转化为Cu²⁺、Mg²⁺,向反应后溶液中逐滴滴加NaOH溶液,得到的21.4g沉淀为Cu(OH)₂、Mg(OH)₂,设铜镁合金中Cu、Mg的物质的量分别为xmol、ymol,则64x+24y=11.2①,98x+58y=21.4②,由①②解得x=0.1,y=0.2,即该合金中铜与镁的物质的量分别为0.1mol、0.2mol。
[解析]由分析可知,该合金中铜与镁的质量之比为$\frac{64g·mol⁻¹×0.1mol}{24g·mol⁻¹×0.2mol}$=$\frac{4}{3}$,A正确;由题意知,HNO₃与铜镁合金反应的产物为NO、NO₂、Cu(NO₃)₂、Mg(NO₃)₂,原硝酸的物质的量n(HNO₃)=2n(Mg²⁺)+2n(Cu²⁺)+n(NO)+n(NO₂)=2×0.2mol+2×0.1mol+0.5mol=1.1mol,则原硝酸物质的量浓度为11mol·L⁻¹,B错误;氮元素在反应中有一部分化合价降低得到NO和NO₂,还有一部分化合价未发生变化得到Cu(NO₃)₂、Mg(NO₃)₂,所以硝酸既体现氧化性又体现酸性,C正确;设生成的NO和NO₂的物质的量分别为amol、bmol,则a+b=0.5,根据得失电子守恒,3a+b=2×0.1+2×0.2,两式联立可得:a=0.05,b=0.45,由于NO+NO₂+2NaOH=2NaNO₂+H₂O、2NO₂+2NaOH=NaNO₂+NaNO₃+H₂O,当$\frac{n(NO₂)}{n(NO)}$≥1时,氮氧化物能被NaOH完全吸收,所以该反应过程中的氮氧化物能被完全吸收,D正确。
5. [安徽合肥八中 2024 高一期中]为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是(

A.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
B.②中灼热的铁片可与浓硝酸发生反应,生成红棕色的$NO_2$
C.将带火星的木条靠近①的试管口,木条复燃,说明$NO_2$支持燃烧
D.⑤中的红棕色气体可以证明浓硝酸有不稳定性
D
)
A.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
B.②中灼热的铁片可与浓硝酸发生反应,生成红棕色的$NO_2$
C.将带火星的木条靠近①的试管口,木条复燃,说明$NO_2$支持燃烧
D.⑤中的红棕色气体可以证明浓硝酸有不稳定性
答案:
5.D [解析]①中浓硝酸受热分解生成NO₂;②中灼热的铁片与浓硝酸发生反应生成NO₂;③中灼热的铜片与浓硝酸发生反应生成NO₂;④中挥发出的HNO₃受热发生分解反应生成NO₂;⑤中除硝酸分解外,灼热的木炭与浓硝酸也会发生反应生成NO₂:C+4HNO₃(浓)$\xlongequal{\triangle}$4NO₂↑+CO₂↑+2H₂O。浓硝酸易挥发,挥发出的HNO₃受热发生分解反应生成红棕色的NO₂,A正确;灼热的铁片与浓硝酸发生反应生成红棕色的NO₂,B正确;灼热的玻璃棒插入浓硝酸中,HNO₃分解生成NO₂、O₂和H₂O,分解产生的二氧化氮与氧气的物质的量之比为4:1,与空气中氮气与氧气的比例相当,空气不能使带火星的木条复燃,而混合气使带火星的木条复燃,说明二氧化氮支持燃烧,C正确;⑤中灼热的木炭与浓硝酸发生氧化还原反应也会产生红棕色气体,不能根据生成红棕色气体判断发生了分解反应,即不能证明浓硝酸有不稳定性,D错误。
6. [福建福州 2025 高一期末]铁与不同密度的$HNO_3$溶液反应时产生的含氮产物的百分含量分布如图所示,下列有关说法错误的是(

A.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
B.一般来说,不同密度的硝酸与铁反应的还原产物不是单一的
C.$P$点处氧化剂与还原剂的物质的量之比一定为$2:3$
D.$N_2$、$NO$、$N_2O$、$NO_2$都既有氧化性又有还原性
C
)
A.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
B.一般来说,不同密度的硝酸与铁反应的还原产物不是单一的
C.$P$点处氧化剂与还原剂的物质的量之比一定为$2:3$
D.$N_2$、$NO$、$N_2O$、$NO_2$都既有氧化性又有还原性
答案:
6.C [解析]由题图可知,硝酸的密度越大,其还原产物中高价态的成分所占比例越多,A正确;由题图可知,一般来说,不同密度的硝酸与铁反应的还原产物不是单一的,B正确;P点处生成的NO₂和NO的百分含量相等,则生成的NO₂和NO物质的量之比为1:1,但铁与硝酸反应生成的不一定是Fe³⁺,也可能是Fe²⁺,P点处氧化剂与还原剂的物质的量之比无法确定,C错误;氮元素的最低化合价为−3价,最高价为+5价,N₂、NO、N₂O、NO₂中的N都处于中间价态,都既有氧化性又有还原性,D正确。
查看更多完整答案,请扫码查看


