2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [浙江部分学校 2025 高一月考]柔性电池因其可弯曲、折叠和拉伸等特点,成为可穿戴设备、软体机器人和植入式医疗设备等的重要组成部分。某柔性电池的结构如图所示,下列说法不正确的是(
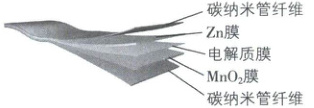
电池的总反应:${Zn + MnO_{2}\xlongequal {电解质}ZnO + MnO}$
A.含有${Zn}$膜的碳纳米管纤维作电池的负极
B.${MnO_{2}}$在电池的正极失去电子,发生氧化反应
C.电池工作时,离子通过电解质膜进行迁移
D.电池工作时,化学能主要转化为电能
B
)
电池的总反应:${Zn + MnO_{2}\xlongequal {电解质}ZnO + MnO}$
A.含有${Zn}$膜的碳纳米管纤维作电池的负极
B.${MnO_{2}}$在电池的正极失去电子,发生氧化反应
C.电池工作时,离子通过电解质膜进行迁移
D.电池工作时,化学能主要转化为电能
答案:
1.B 【解析】根据题目信息可知,电池的总反应为 Zn + MnO₂ $\xlongequal{电解质}$ ZnO + MnO,则负极反应式为 Zn - 2e⁻ + O²⁻ = ZnO,正极反应式为 MnO₂ + 2e⁻ = MnO + O²⁻,电解质膜用于传递 O²⁻。含有 Zn 膜的碳纳米管纤维作电池的负极,A 正确;MnO₂ 在电池的正极得电子,发生还原反应,B 错误;电池工作时,O²⁻ 通过电解质膜进行迁移,C 正确;原电池是将化学能转化为电能的装置,因此电池工作时化学能主要转化为电能,D 正确。
2. [山东烟台 2025 高一期中]我国科学家设计的“海泥电池”工作原理如图,微生物代谢产物显酸性。下列说法正确的是(
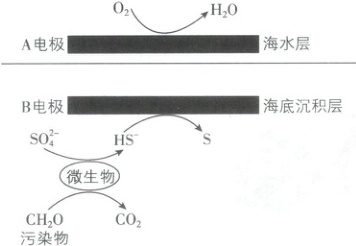
A.电子从${A}$电极流向${B}$电极
B.${B}$电极附近酸性减弱
C.${H^{+}}$从海水层通过交界面向海底沉积层移动
D.除去$1.5\ {g CH_{2}O}$,消耗标准状况下$0.28\ {L O_{2}}$
D
)
A.电子从${A}$电极流向${B}$电极
B.${B}$电极附近酸性减弱
C.${H^{+}}$从海水层通过交界面向海底沉积层移动
D.除去$1.5\ {g CH_{2}O}$,消耗标准状况下$0.28\ {L O_{2}}$
答案:
2.D 【解析】从图中可知,A 电极上 O₂ 得电子转化为 H₂O,A 电极为正极,B 电极上 HS⁻ 失电子生成 S,B 电极为负极。电子从负极(B 电极)流向正极(A 电极),A 错误;B 电极上 HS⁻ 失电子生成 S,电极反应式为 HS⁻ - 2e⁻ = S + H⁺,生成 H⁺,酸性增强,B 错误;原电池中 H⁺ 向正极移动,因此 H⁺ 应向海水层移动,C 错误;根据得失电子守恒可得关系式:O₂ ~ 2HS⁻,微生物代谢反应为 SO₄²⁻ + 2CH₃O + H⁺ = HS⁻ + 2CO₂ + 2H₂O,可得关系式 O₂ ~ 2HS⁻ ~ 4CH₃O,1.5 g CH₃O 物质的量为 0.05 mol,消耗氧气 0.0125 mol,标准状况下体积为 0.28 L,D 正确。
3. [天津和平区 2024 高一期中]流动电池是一种新型电池,其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应式为${Cu + PbO_{2} + 2H_{2}SO_{4}\xlongequal{}CuSO_{4} + PbSO_{4} + 2H_{2}O}$。下列说法正确的是(
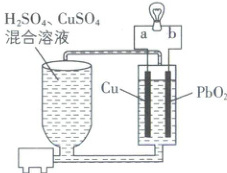
A.${b}$为负极,${a}$为正极
B.该电池工作时,电流由电极${a}$流向电极${b}$
C.${b}$极的电极反应式为${PbO_{2} + 4H^{+} + 2e^{-}\xlongequal{}Pb^{2 + } + 2H_{2}O}$
D.调节电解质溶液的方法是补充${H_{2}SO_{4}}$
D
)
A.${b}$为负极,${a}$为正极
B.该电池工作时,电流由电极${a}$流向电极${b}$
C.${b}$极的电极反应式为${PbO_{2} + 4H^{+} + 2e^{-}\xlongequal{}Pb^{2 + } + 2H_{2}O}$
D.调节电解质溶液的方法是补充${H_{2}SO_{4}}$
答案:
3.D
思路导引 电池的总反应为 Cu + PbO₂ + 2H₂SO₄ = CuSO₄ + PbSO₄ + 2H₂O,则 Cu 失电子发生氧化反应,PbO₂ 得电子发生还原反应;所以 a 为负极,b 为正极。
【解析】a 为负极,b 为正极,A 错误;电流由正极流向负极,故电池工作时,电流由电极 b 流向电极 a,B 错误;PbO₂ 得电子发生还原反应,电极反应式为 PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O,C 错误;由电池的总反应可知,硫酸被消耗,则调节电解质溶液的方法是补充 H₂SO₄,D 正确。
思路导引 电池的总反应为 Cu + PbO₂ + 2H₂SO₄ = CuSO₄ + PbSO₄ + 2H₂O,则 Cu 失电子发生氧化反应,PbO₂ 得电子发生还原反应;所以 a 为负极,b 为正极。
【解析】a 为负极,b 为正极,A 错误;电流由正极流向负极,故电池工作时,电流由电极 b 流向电极 a,B 错误;PbO₂ 得电子发生还原反应,电极反应式为 PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O,C 错误;由电池的总反应可知,硫酸被消耗,则调节电解质溶液的方法是补充 H₂SO₄,D 正确。
4. [广东湛江 2025 高一期中]热电化学电池,也称热电池,是一种电化学系统。热电化学电池由两个相同的电极和含有氧化/还原电对的电解液组成。一种以${K_{4}[Fe(CN)_{6}]}$和${K_{3}[Fe(CN)_{6}]}$的混合溶液为电解液的热电化学电池工作原理如图所示。下列说法正确的是(
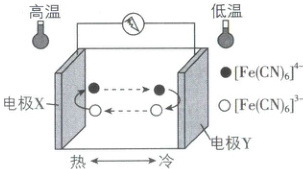
A.电极${Y}$为负极,发生还原反应
B.外电路中,电流由电极${X}$经过导线流向电极${Y}$
C.电池工作时,${K^{+}}$向电极${Y}$移动
D.正极的电极反应式为${[Fe(CN)_{6}]^{3 - } - e^{-}\xlongequal{}[Fe(CN)_{6}]^{4 - }}$
B
)
A.电极${Y}$为负极,发生还原反应
B.外电路中,电流由电极${X}$经过导线流向电极${Y}$
C.电池工作时,${K^{+}}$向电极${Y}$移动
D.正极的电极反应式为${[Fe(CN)_{6}]^{3 - } - e^{-}\xlongequal{}[Fe(CN)_{6}]^{4 - }}$
答案:
4.B 【解析】由题图知,电极 Y 发生 [Fe(CN)₆]⁴⁻ - e⁻ = [Fe(CN)₆]³⁻,因此电极 Y 为负极,发生氧化反应,A 错误;外电路中,电流由正极即电极 X 经过导线流向负极即电极 Y,B 正确;电池工作时,K⁺ 向正极即电极 X 移动,C 错误;正极发生还原反应,则电极反应式为 [Fe(CN)₆]³⁻ + e⁻ = [Fe(CN)₆]⁴⁻,D 错误。
5. [江苏南京师大附中 2025 高一期中]一种室内甲醛传感器测量甲醛含量的工作原理如图所示。已知:标准室内甲醛含量不超过$0.080\ {mg· m^{-3}}$,下列说法错误的是(
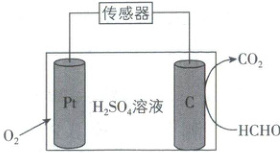
A.外电路电流方向由${Pt}$电极到${C}$电极
B.负极反应式为${HCHO + H_{2}O - 4e^{-}\xlongequal{}CO_{2} + 4H^{+}}$
C.随测量进行,${H_{2}SO_{4}}$溶液浓度逐渐变小
D.传感器在$27\ {m^{3}}$室内空间测量时,电路中转移$5.4× 10^{-4}\ {mol e^{-}}$,该室内甲醛含量符合标准
D
)
A.外电路电流方向由${Pt}$电极到${C}$电极
B.负极反应式为${HCHO + H_{2}O - 4e^{-}\xlongequal{}CO_{2} + 4H^{+}}$
C.随测量进行,${H_{2}SO_{4}}$溶液浓度逐渐变小
D.传感器在$27\ {m^{3}}$室内空间测量时,电路中转移$5.4× 10^{-4}\ {mol e^{-}}$,该室内甲醛含量符合标准
答案:
5.D
图解

【解析】外电路电流方向是从正极流向负极,即从 Pt 电极流向 C 电极,A 正确;负极反应式为 HCHO + H₂O - 4e⁻ = CO₂ + 4H⁺,B 正确;电池工作总反应为 HCHO + O₂ = CO₂ + H₂O,随检测的进行,n(H₂SO₄) 不变,生成的水增多,H₂SO₄ 溶液浓度逐渐变小,C 正确;由分析可知,每转移 4 mol e⁻ 时,消耗 1 mol HCHO,则转移 5.4 × 10⁻⁴ mol e⁻ 时,消耗的 HCHO 的物质的量为 $\frac{5.4 × 10^{-4} mol}{4} = 1.35 × 10^{-4} mol$,则室内甲醛含量为 $\frac{1.35 × 10^{-4} mol × 30 g · mol^{-1} × 1000 mg · g^{-1}}{27 m^{3}} = 0.150 mg · m^{-3} > 0.080 mg · m^{-3}$,该室内甲醛含量不符合标准,D 错误。
5.D
图解

【解析】外电路电流方向是从正极流向负极,即从 Pt 电极流向 C 电极,A 正确;负极反应式为 HCHO + H₂O - 4e⁻ = CO₂ + 4H⁺,B 正确;电池工作总反应为 HCHO + O₂ = CO₂ + H₂O,随检测的进行,n(H₂SO₄) 不变,生成的水增多,H₂SO₄ 溶液浓度逐渐变小,C 正确;由分析可知,每转移 4 mol e⁻ 时,消耗 1 mol HCHO,则转移 5.4 × 10⁻⁴ mol e⁻ 时,消耗的 HCHO 的物质的量为 $\frac{5.4 × 10^{-4} mol}{4} = 1.35 × 10^{-4} mol$,则室内甲醛含量为 $\frac{1.35 × 10^{-4} mol × 30 g · mol^{-1} × 1000 mg · g^{-1}}{27 m^{3}} = 0.150 mg · m^{-3} > 0.080 mg · m^{-3}$,该室内甲醛含量不符合标准,D 错误。
查看更多完整答案,请扫码查看


