2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [陕西汉中2025高一月考]下列装置工作时,将化学能转化为电能的是(

]
C
)
]
答案:
1.C 【解析】风力发电机是将风能转化为电能,A错误;硅太阳能电池是将太阳能转化为电能,B错误;铅酸蓄电池工作时是原电池,发生氧化还原反应,将化学能转化为电能,C正确;电解水装置是将电能转化为化学能,D错误。
2. 化学反应速率和限度的研究对日常生活和工业生产有着重要意义。下列有关说法错误的是(
A.向炉膛内鼓风、用煤粉代替煤块都可以使炉火更旺
B.将肉类食品进行低温冷藏,能使其永远不会腐败变质
C.工业合成氨时,使用过量的N₂也不可能使H₂的转化率达到100%
D.我国西周时期已经发明了用酒曲酿酒,其原理是催化剂能改变反应速率
B
)A.向炉膛内鼓风、用煤粉代替煤块都可以使炉火更旺
B.将肉类食品进行低温冷藏,能使其永远不会腐败变质
C.工业合成氨时,使用过量的N₂也不可能使H₂的转化率达到100%
D.我国西周时期已经发明了用酒曲酿酒,其原理是催化剂能改变反应速率
答案:
2.B 【解析】相同条件下,增大反应物的浓度或增大反应物的接触面积均可加快反应速率,所以向炉膛内鼓风、用煤粉代替煤块都可以使燃烧更快,炉火更旺,A正确;低温冷藏只能减慢肉类食品的变质速率,B错误;工业合成氨发生的是可逆反应,H₂不能完全转化,故H₂的转化率不能达到100%,C正确;酒曲中含有酶,在酿酒过程中作催化剂,能加快反应速率,D正确。
3. H₂和I₂在一定条件下能发生反应:H₂(g)+I₂(g)⇌2HI(g),生成2mol HI(g)时反应放出a kJ能量(a、b、c均大于0),下列说法正确的是(

A.反应物的总能量低于生成物的总能量
B.断开1mol H—H和1mol I—I所需能量大于断开2mol H—I所需能量
C.向密闭容器中加入H₂(g)和I₂(s),生成2mol HI(g)放出的能量等于a kJ
D.断开2mol H—I所需能量为(c + b + a)kJ
D
)
A.反应物的总能量低于生成物的总能量
B.断开1mol H—H和1mol I—I所需能量大于断开2mol H—I所需能量
C.向密闭容器中加入H₂(g)和I₂(s),生成2mol HI(g)放出的能量等于a kJ
D.断开2mol H—I所需能量为(c + b + a)kJ
答案:
3.D 【解析】根据题意,H₂(g)与I₂(g)反应生成HI(g)放热,所以反应物的总能量比生成物的总能量高,A错误;因为该反应为放热反应,所以断开1molH—H和1molI—I所需要的能量小于断开2molH—I所需要的能量,B错误;I₂(s)→I₂(g)吸收能量,则H₂(g)和I₂(s)的能量低于H₂(g)和I₂(g)的能量,故H₂(g)和I₂(s)反应生成2molHI(g)放出的能量小于a kJ,C错误;设断开2molH—I所需能量为x kJ,则x-(b+c)=a,解得x=c+b+a,D正确。
突破点:同一物质断开化学键吸收的能量=形成化学键放出的能量
突破点:同一物质断开化学键吸收的能量=形成化学键放出的能量
4. [山东济宁2025高一期中]利用如图装置可达到烟气脱硫和获得电能的目的。下列说法正确的是(

A.多孔电极的反应式为SO₂ - 2e⁻ + 2H₂O = 4H⁺ + SO₄²⁻
B.工作一段时间后,右室电解质溶液的pH增大
C.理论上,相同条件下吸收SO₂的体积和产生H₂的体积相同
D.工作一段时间后,左室需要补充Fe₂(SO₄)₃溶液
C
)
A.多孔电极的反应式为SO₂ - 2e⁻ + 2H₂O = 4H⁺ + SO₄²⁻
B.工作一段时间后,右室电解质溶液的pH增大
C.理论上,相同条件下吸收SO₂的体积和产生H₂的体积相同
D.工作一段时间后,左室需要补充Fe₂(SO₄)₃溶液
答案:
4.C
图解

电极反应式:Fe²⁺ - e⁻ = Fe³⁺ 电极反应式:2H⁺ + 2e⁻ = H₂↑
Fe³⁺氧化SO₂生成SO₄²⁻,达到脱硫的目的,反应的方程式为2Fe³⁺ + SO₂ + 2H₂O = 2Fe²⁺ + 4H⁺ + SO₄²⁻
【解析】由分析可知,多孔电极上发生的反应为Fe²⁺ - e⁻ = Fe³⁺,A错误;负极室产生的H⁺经质子交换膜移向正极室,根据电荷守恒可知,正极室(右室)每消耗2molH⁺,则有2molH⁺从左室经质子交换膜进入右室,故右室中H₂SO₄溶液的浓度保持不变,pH不变,B错误;由图解可以得到关系式H₂~2e⁻~2Fe³⁺~SO₂,当电路中转移2mol e⁻时,正极生成1molH₂,负极消耗1molSO₂,故理论上相同条件下吸收SO₂的体积和产生H₂的体积相同,C正确;Fe₂(SO₄)₃氧化SO₂生成FeSO₄,FeSO₄又在电极上放电生成Fe₂(SO₄)₃,所以不需要补充Fe₂(SO₄)₃溶液,D错误。
4.C
图解

电极反应式:Fe²⁺ - e⁻ = Fe³⁺ 电极反应式:2H⁺ + 2e⁻ = H₂↑
Fe³⁺氧化SO₂生成SO₄²⁻,达到脱硫的目的,反应的方程式为2Fe³⁺ + SO₂ + 2H₂O = 2Fe²⁺ + 4H⁺ + SO₄²⁻
【解析】由分析可知,多孔电极上发生的反应为Fe²⁺ - e⁻ = Fe³⁺,A错误;负极室产生的H⁺经质子交换膜移向正极室,根据电荷守恒可知,正极室(右室)每消耗2molH⁺,则有2molH⁺从左室经质子交换膜进入右室,故右室中H₂SO₄溶液的浓度保持不变,pH不变,B错误;由图解可以得到关系式H₂~2e⁻~2Fe³⁺~SO₂,当电路中转移2mol e⁻时,正极生成1molH₂,负极消耗1molSO₂,故理论上相同条件下吸收SO₂的体积和产生H₂的体积相同,C正确;Fe₂(SO₄)₃氧化SO₂生成FeSO₄,FeSO₄又在电极上放电生成Fe₂(SO₄)₃,所以不需要补充Fe₂(SO₄)₃溶液,D错误。
5. [安徽三市2024高一期末联考]已知反应:3A(g)+B(g)⇌xC(g)+2D(g),现将等物质的量的A、B混合于2L的密闭容器中反应,2min后测得D的浓度为0.5mol·L⁻¹,c(A):c(B)=3:5,以C表示的平均反应速率v(C)=0.25mol·L⁻¹·min⁻¹,下列说法错误的是(
A.x = 2
B.2min末,C的物质的量为1mol
C.0~2min内,A的转化率为50%
D.0~2min内,该反应的平均反应速率v(A):v(D)=2:3
D
)A.x = 2
B.2min末,C的物质的量为1mol
C.0~2min内,A的转化率为50%
D.0~2min内,该反应的平均反应速率v(A):v(D)=2:3
答案:
5.D
思路导引设A、B的起始物质的量均为n mol,2min时生成D的物质的量n(D)=2L×0.5mol·L⁻¹ = 1mol,v(C)=0.25mol·L⁻¹·min⁻¹,则n(C)=0.25mol·L⁻¹·min⁻¹×2min×2L = 1mol,0~2min的Δn(C)=Δn(D),则x = 2,根据题意列三段式如下:
3A(g) + B(g)⇌2C(g) + 2D(g)
开始/mol n n 0 0
转化/mol 1.5 0.5 1 1
2min末/mol n - 1.5 n - 0.5 1 1
2min时c(A):c(B)=3:5,则(n - 1.5)/(n - 0.5)=3/5,解得n = 3。
【解析】由思路导引知x = 2,A正确;由思路导引知,2min时,n(C)=1mol,B正确;由思路导引知,A的初始投料为3mol,则0~2min内,A的转化率为1.5mol/3mol×100% = 50%,C正确;由方程式可知,A、D的化学计量数比为3:2,则v(A):v(D)=3:2,D错误。
思路导引设A、B的起始物质的量均为n mol,2min时生成D的物质的量n(D)=2L×0.5mol·L⁻¹ = 1mol,v(C)=0.25mol·L⁻¹·min⁻¹,则n(C)=0.25mol·L⁻¹·min⁻¹×2min×2L = 1mol,0~2min的Δn(C)=Δn(D),则x = 2,根据题意列三段式如下:
3A(g) + B(g)⇌2C(g) + 2D(g)
开始/mol n n 0 0
转化/mol 1.5 0.5 1 1
2min末/mol n - 1.5 n - 0.5 1 1
2min时c(A):c(B)=3:5,则(n - 1.5)/(n - 0.5)=3/5,解得n = 3。
【解析】由思路导引知x = 2,A正确;由思路导引知,2min时,n(C)=1mol,B正确;由思路导引知,A的初始投料为3mol,则0~2min内,A的转化率为1.5mol/3mol×100% = 50%,C正确;由方程式可知,A、D的化学计量数比为3:2,则v(A):v(D)=3:2,D错误。
6. [宁夏石嘴山2025高一期末]为探究化学反应速率的影响因素,设计实验装置。能达到相应实验目的的是(
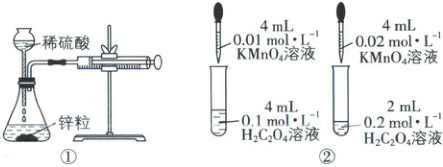

A.装置①用于测定生成氢气的速率
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.装置③依据U形管两边液面的高低判断Na和水反应是否放热
D.装置④依据出现浑浊的快慢比较温度对反应速率的影响
C
)

A.装置①用于测定生成氢气的速率
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.装置③依据U形管两边液面的高低判断Na和水反应是否放热
D.装置④依据出现浑浊的快慢比较温度对反应速率的影响
答案:
6.C 【解析】装置①生成的氢气会由长颈漏斗逸出,应用分液漏斗或将长颈漏斗插入液面以下,形成液封,A错误;装置②依据褪色快慢比较浓度对反应速率的影响,应保证高锰酸钾溶液的浓度和体积相同,用不同浓度、相同体积的草酸来做实验,保证混合液中有色离子的浓度相同,B错误;Na和水反应放热,广口瓶内气体受热膨胀,U形管左侧液面下降,右侧液面上升,装置③能达到目的,C正确;装置④中浓度、温度都不同,无法判断温度对反应速率的影响,D错误。
查看更多完整答案,请扫码查看


