2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
7. 为探究H₂O₂、SO₂、Br₂的氧化性强弱,某小组同学设计如图所示实验(夹持及尾气处理装置已略去,装置气密性已检验;查阅资料可知Br₂易溶于CCl₄)。
(1)A中发生的反应
(2)B中红棕色溴水褪色,此时发生反应的离子方程式为
(3)C中产生的白色沉淀是
(4)甲同学根据C中产生白色沉淀得出的结论为氧化性:H₂O₂>SO₂。
乙同学认为不能得出此结论,并对实验进行了改进:打开弹簧夹,通入N₂,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞。
丙同学进行了进一步的改进:在B和C之间增加盛放CCl₄的洗气瓶D,目的是
根据乙同学和丙同学改进后的方案进行实验,C中产生白色沉淀,得出的结论为氧化性:H₂O₂>SO₂。
(5)iii中滴入少量H₂O₂溶液没有明显变化,提出假设:
假设1 H₂O₂的量少,不能氧化Br⁻;
假设2 B中有未反应的H₂SO₃。
为验证假设2,应进行的实验操作及现象:取滴加少量H₂O₂溶液前的B中溶液于试管中,______,假设2成立。
继续滴加H₂O₂溶液,一段时间后,溶液逐渐变成红棕色,此时发生反应的离子方程式为
(6)通过上述全部实验,得出结论:H₂O₂、SO₂、Br₂的氧化性由强到弱的顺序是
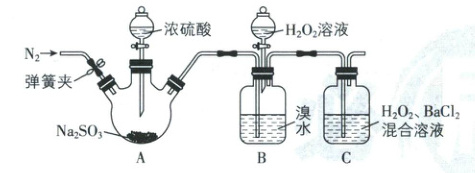

(1)A中发生的反应
不是
(填“是”或“不是”)氧化还原反应。(2)B中红棕色溴水褪色,此时发生反应的离子方程式为
Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺
。(3)C中产生的白色沉淀是
BaSO₄
。(4)甲同学根据C中产生白色沉淀得出的结论为氧化性:H₂O₂>SO₂。
乙同学认为不能得出此结论,并对实验进行了改进:打开弹簧夹,通入N₂,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞。
丙同学进行了进一步的改进:在B和C之间增加盛放CCl₄的洗气瓶D,目的是
吸收挥发出的溴蒸气,防止干扰实验
。根据乙同学和丙同学改进后的方案进行实验,C中产生白色沉淀,得出的结论为氧化性:H₂O₂>SO₂。
(5)iii中滴入少量H₂O₂溶液没有明显变化,提出假设:
假设1 H₂O₂的量少,不能氧化Br⁻;
假设2 B中有未反应的H₂SO₃。
为验证假设2,应进行的实验操作及现象:取滴加少量H₂O₂溶液前的B中溶液于试管中,______,假设2成立。
继续滴加H₂O₂溶液,一段时间后,溶液逐渐变成红棕色,此时发生反应的离子方程式为
2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O
。(6)通过上述全部实验,得出结论:H₂O₂、SO₂、Br₂的氧化性由强到弱的顺序是
H₂O₂ > Br₂ > SO₂
。

答案:
7.
(1)不是
(2)Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺
(3)硫酸钡(或BaSO₄)
(4)吸收挥发出来的溴蒸气,防止干扰实验
(5)加热,将气体通入品红溶液中,品红溶液褪色;2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O
(6)H₂O₂ > Br₂ > SO₂
思路导引:A中浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫进入B中,和溴单质反应生成溴离子,再向B中滴加过氧化氢溶液,过氧化氢又将溴离子氧化为溴单质,C中生成不溶于酸的白色沉淀,说明沉淀为硫酸钡。
[解析]
(1)浓硫酸和亚硫酸钠反应生成二氧化硫、硫酸钠和水,反应中没有元素化合价改变,不是氧化还原反应。
(2)二氧化硫具有还原性,B中红棕色溴水褪色,说明溴单质和二氧化硫发生氧化还原反应生成SO₄²⁻和Br⁻,反应的离子方程式为Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺。
(3)取C中沉淀于试管中,加入稀盐酸,沉淀不溶解,说明C中生成的沉淀是BaSO₄。
(4)Br₂易挥发,若Br₂挥发进入C中,溴单质也可以将SO₂氧化为SO₄²⁻,Br₂易溶于CCl₄,所以在B和C之间增加盛放CCl₄的洗气瓶D,可吸收挥发出的溴蒸气,防止干扰实验。
(5)H₂SO₃不稳定,受热容易分解产生有漂白性的SO₂,所以为验证假设2成立,应进行的实验操作及现象:取滴加少量H₂O₂溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色。继续滴加H₂O₂溶液,一段时间后,溶液的颜色逐渐变成红棕色,说明过氧化氢将溴离子氧化为溴单质,故此时发生反应的离子方程式为2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O。
(6)结合上述分析,由Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺可知,溴单质的氧化性强于二氧化硫的氧化性;同一氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,由2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O可知,过氧化氢的氧化性强于溴单质的氧化性,故H₂O₂、SO₂、Br₂的氧化性由强到弱的顺序是H₂O₂ > Br₂ > SO₂。
(1)不是
(2)Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺
(3)硫酸钡(或BaSO₄)
(4)吸收挥发出来的溴蒸气,防止干扰实验
(5)加热,将气体通入品红溶液中,品红溶液褪色;2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O
(6)H₂O₂ > Br₂ > SO₂
思路导引:A中浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫进入B中,和溴单质反应生成溴离子,再向B中滴加过氧化氢溶液,过氧化氢又将溴离子氧化为溴单质,C中生成不溶于酸的白色沉淀,说明沉淀为硫酸钡。
[解析]
(1)浓硫酸和亚硫酸钠反应生成二氧化硫、硫酸钠和水,反应中没有元素化合价改变,不是氧化还原反应。
(2)二氧化硫具有还原性,B中红棕色溴水褪色,说明溴单质和二氧化硫发生氧化还原反应生成SO₄²⁻和Br⁻,反应的离子方程式为Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺。
(3)取C中沉淀于试管中,加入稀盐酸,沉淀不溶解,说明C中生成的沉淀是BaSO₄。
(4)Br₂易挥发,若Br₂挥发进入C中,溴单质也可以将SO₂氧化为SO₄²⁻,Br₂易溶于CCl₄,所以在B和C之间增加盛放CCl₄的洗气瓶D,可吸收挥发出的溴蒸气,防止干扰实验。
(5)H₂SO₃不稳定,受热容易分解产生有漂白性的SO₂,所以为验证假设2成立,应进行的实验操作及现象:取滴加少量H₂O₂溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色。继续滴加H₂O₂溶液,一段时间后,溶液的颜色逐渐变成红棕色,说明过氧化氢将溴离子氧化为溴单质,故此时发生反应的离子方程式为2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O。
(6)结合上述分析,由Br₂ + SO₂ + 2H₂O = SO₄²⁻ + 2Br⁻ + 4H⁺可知,溴单质的氧化性强于二氧化硫的氧化性;同一氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,由2Br⁻ + 2H⁺ + H₂O₂ = Br₂ + 2H₂O可知,过氧化氢的氧化性强于溴单质的氧化性,故H₂O₂、SO₂、Br₂的氧化性由强到弱的顺序是H₂O₂ > Br₂ > SO₂。
8. [北京三十五中2025高一期中]向AgNO₃溶液中通入过量SO₂的过程和现象如图所示。
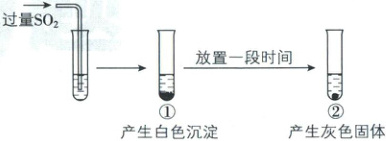
已知酸性条件下NO₃⁻具有强氧化性。经检验,白色沉淀为Ag₂SO₃;灰色固体中含有Ag。下列说法不正确的是(
A.①中生成白色沉淀的离子方程式为$2Ag⁺+SO₂+H₂O\xlongequal{}Ag₂SO₃↓+2H⁺$
B.①中未生成Ag₂SO₄,说明SO₂通到AgNO₃溶液中根本不可能产生Ag₂SO₄
C.②中的现象体现了Ag⁺的氧化性
D.该实验条件下,SO₂与AgNO₃反应生成Ag₂SO₃的速率大于生成Ag的速率

已知酸性条件下NO₃⁻具有强氧化性。经检验,白色沉淀为Ag₂SO₃;灰色固体中含有Ag。下列说法不正确的是(
B
)A.①中生成白色沉淀的离子方程式为$2Ag⁺+SO₂+H₂O\xlongequal{}Ag₂SO₃↓+2H⁺$
B.①中未生成Ag₂SO₄,说明SO₂通到AgNO₃溶液中根本不可能产生Ag₂SO₄
C.②中的现象体现了Ag⁺的氧化性
D.该实验条件下,SO₂与AgNO₃反应生成Ag₂SO₃的速率大于生成Ag的速率
答案:
8.B
图解
[解析]①中生成白色沉淀Ag₂SO₃,离子方程式为2Ag⁺ + SO₂ + H₂O = Ag₂SO₃↓ + 2H⁺,A正确;①中生成了Ag₂SO₃和H⁺,溶液的酸性增强,NO₃⁻可能会氧化Ag₂SO₃生成Ag₂SO₄,故SO₂通入AgNO₃溶液中可能会生成Ag₂SO₄,B错误;②中灰色固体含Ag,说明Ag⁺得电子生成Ag,体现了Ag⁺的氧化性,C正确;实验中先产生白色沉淀Ag₂SO₃,放置一段时间后产生灰色固体Ag,说明SO₂与AgNO₃反应生成Ag₂SO₃的速率大于生成Ag的速率,D正确。
8.B
图解

[解析]①中生成白色沉淀Ag₂SO₃,离子方程式为2Ag⁺ + SO₂ + H₂O = Ag₂SO₃↓ + 2H⁺,A正确;①中生成了Ag₂SO₃和H⁺,溶液的酸性增强,NO₃⁻可能会氧化Ag₂SO₃生成Ag₂SO₄,故SO₂通入AgNO₃溶液中可能会生成Ag₂SO₄,B错误;②中灰色固体含Ag,说明Ag⁺得电子生成Ag,体现了Ag⁺的氧化性,C正确;实验中先产生白色沉淀Ag₂SO₃,放置一段时间后产生灰色固体Ag,说明SO₂与AgNO₃反应生成Ag₂SO₃的速率大于生成Ag的速率,D正确。
查看更多完整答案,请扫码查看


