2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [安徽部分学校 2025 高一联考]硫元素及其化合物之间存在如图所示的转化关系,下列说法正确的是(
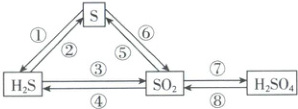
A.反应③可以在氧气不足的情况下实现
B.反应⑥可以在加入过量酸性高锰酸钾溶液的情况下实现
C.反应⑦只需与水化合就能实现
D.反应⑧可以通过复分解反应实现
D
)
A.反应③可以在氧气不足的情况下实现
B.反应⑥可以在加入过量酸性高锰酸钾溶液的情况下实现
C.反应⑦只需与水化合就能实现
D.反应⑧可以通过复分解反应实现
答案:
1.D 【解析】H₂S完全燃烧生成SO₂,氧气不足时,H₂S会被氧气氧化为硫单质,A错误;酸性高锰酸钾溶液具有强氧化性,过量的酸性高锰酸钾溶液会将S直接氧化为硫酸根离子,B错误;二氧化硫需被氧化剂氧化为SO₃后再与水反应才能生成H₂SO₄,SO₂和水反应生成H₂SO₃,C错误;硫酸和亚硫酸钠发生复分解反应生成硫酸钠、二氧化硫和水,D正确。
2. [河北衡水 2024 高一月考]某硫酸厂废气中$SO_{2}$的回收利用方案如图所示,下列说法错误的是(
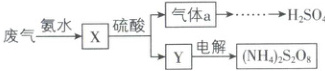
A.$X$可能含有$2$种盐
B.$a$是$SO_{3}$
C.$Y$可能含有$(NH_{4})_{2}SO_{4}$
D.可用热的$NaOH$溶液和湿润的红色石蕊试纸检验$(NH_{4})_{2}S_{2}O_{8}$中的$NH_{4}^{ + }$
B
)
A.$X$可能含有$2$种盐
B.$a$是$SO_{3}$
C.$Y$可能含有$(NH_{4})_{2}SO_{4}$
D.可用热的$NaOH$溶液和湿润的红色石蕊试纸检验$(NH_{4})_{2}S_{2}O_{8}$中的$NH_{4}^{ + }$
答案:
2.B 【解析】废气中的二氧化硫与氨水反应生成亚硫酸铵或亚硫酸氢铵,A正确;亚硫酸铵或亚硫酸氢铵与硫酸反应生成气体a,则气体a为二氧化硫,而不是三氧化硫,B错误;X和硫酸反应生成硫酸铵或硫酸氢铵,C正确;可用热的NaOH溶液和湿润的红色石蕊试纸检验(NH₄)₂S₂O₈中的NH₄⁺,现象是红色石蕊试纸变蓝,D正确。
3. [福建厦门 2024 高一月考]大气污染物$SO_{2}$易溶于水,通常表现出较强的还原性,对人体的呼吸系统和中枢神经系统等均有毒性作用。认识和了解$SO_{2}$的性质可有效防治$SO_{2}$对环境的污染,并实现$SO_{2}$的综合利用。某研究团队提出的$SO_{2}$烟气脱硫工艺流程如下,该流程中脱硫剂可循环利用,实现对烟气中$SO_{2}$的持续脱除。已知:脱硫塔中发生的主要反应为$2CaS+3SO_{2}\xlongequal{}2CaSO_{3}+3S$,$2CaSO_{3}+O_{2}\xlongequal{}2CaSO_{4}$。
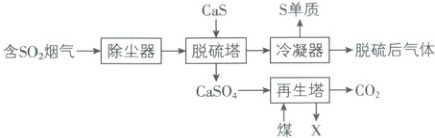
下列有关说法正确的是(
A.脱硫塔中反应生成的$S$为还原产物
B.经冷凝器得到的几种单质$S_{2}$、$S_{4}$、$S_{6}$和$S_{8}$互为同位素
C.将$CaSO_{4}$和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的$X$主要成分为$CaSO_{3}$

下列有关说法正确的是(
C
)A.脱硫塔中反应生成的$S$为还原产物
B.经冷凝器得到的几种单质$S_{2}$、$S_{4}$、$S_{6}$和$S_{8}$互为同位素
C.将$CaSO_{4}$和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的$X$主要成分为$CaSO_{3}$
答案:
3.C 【解析】脱硫塔中发生反应:2CaS+3SO₂=2CaSO₃+3S,反应中CaS→S、SO₂→S,根据价态规律,S既是氧化产物又是还原产物,A错误;S₂、S₄、S₆和S₈为S的不同单质,互为同素异形体,B错误;将CaSO₄和煤粉碎混合,增大反应物间的接触面积,有利于反应充分进行,C正确;再生塔中煤与CaSO₄反应生成CO₂和X,根据原子守恒和得失电子守恒,并结合题干信息“脱硫剂可循环利用”,可判断X为CaS,D错误。
4. [广东深圳外国语学校 2025 高一期中]$Na_{2}S_{2}O_{3}$是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成$S$和$SO_{2}$。某小组设计了如图实验装置制备$Na_{2}S_{2}O_{3}$(夹持及加热仪器略)。回答下列问题:
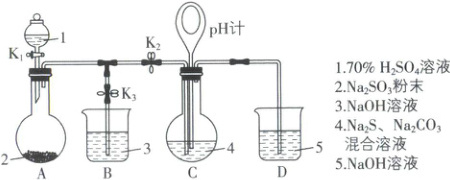
(1)装置$A$的作用是制备$SO_{2}$,反应的化学方程式为
(2)完成如表实验过程:

(3)该实验以$n(Na_{2}S):n(Na_{2}CO_{3}) = 2:1$反应并生成$Na_{2}S_{2}O_{3}$,写出制备$Na_{2}S_{2}O_{3}$的总反应的化学方程式:
(4)$Na_{2}S_{2}O_{3}$有还原性,可作脱氯剂。向$Na_{2}S_{2}O_{3}$溶液中通入少量$Cl_{2}$,某同学预测$S_{2}O_{3}^{2 - }$转化为$SO_{4}^{2 - }$,设计实验验证该预测:取少量反应后的溶液于试管中,

(1)装置$A$的作用是制备$SO_{2}$,反应的化学方程式为
Na₂SO₃+H₂SO₄(浓)=Na₂SO₄+SO₂↑+H₂O
。(2)完成如表实验过程:

(3)该实验以$n(Na_{2}S):n(Na_{2}CO_{3}) = 2:1$反应并生成$Na_{2}S_{2}O_{3}$,写出制备$Na_{2}S_{2}O_{3}$的总反应的化学方程式:
2Na₂S+Na₂CO₃+4SO₂=3Na₂S₂O₃+CO₂
。(4)$Na_{2}S_{2}O_{3}$有还原性,可作脱氯剂。向$Na_{2}S_{2}O_{3}$溶液中通入少量$Cl_{2}$,某同学预测$S_{2}O_{3}^{2 - }$转化为$SO_{4}^{2 - }$,设计实验验证该预测:取少量反应后的溶液于试管中,
加入过量盐酸,充分反应后,静置,向上层清液中滴加BaCl₂溶液,有白色沉淀生成
。
答案:
4.
(1)Na₂SO₃+H₂SO₄(浓)=Na₂SO₄+SO₂↑+H₂O
(2)①溶液出现黄色浑浊,然后逐渐澄清(或浑浊减少)
②减小 ③关闭K₁、K₂,同时打开K₃ ④SO₂过量会使溶液呈酸性,产物分解,产率降低
(3)2Na₂S+Na₂CO₃+4SO₂=3Na₂S₂O₃+CO₂
(4)加入过量盐酸,充分反应后,静置,向上层清液中滴加BaCl₂溶液,有白色沉淀生成
【解析】
(1)根据装置A中原料,可知装置A中发生反应的化学方程式为Na₂SO₃+H₂SO₄(浓)=Na₂SO₄+SO₂↑+H₂O。
(2)①根据反应分步进行的化学方程式:Na₂CO₃+SO₂=Na₂SO₃+CO₂,2Na₂S+3SO₂=2Na₂SO₃+3S↓,Na₂SO₃+S=Na₂S₂O₃(较慢),可知随SO₂的通入,有黄色沉淀产生,溶液变浑浊,然后生成的S被逐渐消耗,溶液逐渐变澄清。
②SO₂是酸性气体,反应消耗Na₂CO₃、Na₂S(Na₂CO₃、Na₂S的混合溶液呈碱性),生成Na₂S₂O₃和CO₂,溶液pH减小,故pH计读数逐渐减小。③当pH计读数接近7时,立即停止通SO₂,操作是关闭K₁、K₂,同时打开K₃,用NaOH溶液吸收过量SO₂。④已知Na₂S₂O₃在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO₂,若pH接近7时继续通入SO₂,会使溶液呈酸性,Na₂S₂O₃分解,产率降低。
(3)以n(Na₂S):n(Na₂CO₃)=2:1反应生成Na₂S₂O₃,故制备Na₂S₂O₃的总反应的化学方程式为2Na₂S+Na₂CO₃+4SO₂=3Na₂S₂O₃+CO₂。
(4)检验SO₄²⁻时要先加盐酸酸化,再滴加BaCl₂溶液,由于通入的氯气少量,而过量的Na₂S₂O₃与盐酸反应会产生S(黄色浑浊),不利于观察BaSO₄白色沉淀,故要先除去Na₂S₂O₃;因此具体操作是取少量反应后的溶液于试管中,加入过量盐酸,充分反应后,静置,向上层清液中滴加BaCl₂溶液,有白色沉淀生成。
(1)Na₂SO₃+H₂SO₄(浓)=Na₂SO₄+SO₂↑+H₂O
(2)①溶液出现黄色浑浊,然后逐渐澄清(或浑浊减少)
②减小 ③关闭K₁、K₂,同时打开K₃ ④SO₂过量会使溶液呈酸性,产物分解,产率降低
(3)2Na₂S+Na₂CO₃+4SO₂=3Na₂S₂O₃+CO₂
(4)加入过量盐酸,充分反应后,静置,向上层清液中滴加BaCl₂溶液,有白色沉淀生成
【解析】
(1)根据装置A中原料,可知装置A中发生反应的化学方程式为Na₂SO₃+H₂SO₄(浓)=Na₂SO₄+SO₂↑+H₂O。
(2)①根据反应分步进行的化学方程式:Na₂CO₃+SO₂=Na₂SO₃+CO₂,2Na₂S+3SO₂=2Na₂SO₃+3S↓,Na₂SO₃+S=Na₂S₂O₃(较慢),可知随SO₂的通入,有黄色沉淀产生,溶液变浑浊,然后生成的S被逐渐消耗,溶液逐渐变澄清。
②SO₂是酸性气体,反应消耗Na₂CO₃、Na₂S(Na₂CO₃、Na₂S的混合溶液呈碱性),生成Na₂S₂O₃和CO₂,溶液pH减小,故pH计读数逐渐减小。③当pH计读数接近7时,立即停止通SO₂,操作是关闭K₁、K₂,同时打开K₃,用NaOH溶液吸收过量SO₂。④已知Na₂S₂O₃在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO₂,若pH接近7时继续通入SO₂,会使溶液呈酸性,Na₂S₂O₃分解,产率降低。
(3)以n(Na₂S):n(Na₂CO₃)=2:1反应生成Na₂S₂O₃,故制备Na₂S₂O₃的总反应的化学方程式为2Na₂S+Na₂CO₃+4SO₂=3Na₂S₂O₃+CO₂。
(4)检验SO₄²⁻时要先加盐酸酸化,再滴加BaCl₂溶液,由于通入的氯气少量,而过量的Na₂S₂O₃与盐酸反应会产生S(黄色浑浊),不利于观察BaSO₄白色沉淀,故要先除去Na₂S₂O₃;因此具体操作是取少量反应后的溶液于试管中,加入过量盐酸,充分反应后,静置,向上层清液中滴加BaCl₂溶液,有白色沉淀生成。
查看更多完整答案,请扫码查看


