2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
7. [山东潍坊2025高一期中]某学习小组为测定化学反应速率,并探究外界条件对化学反应速率的影响,进行如下实验。
Ⅰ. 甲同学利用图甲所示装置测定化学反应速率。
已知:2MnO₄⁻+5H₂C₂O₄+6H⁺=2Mn²⁺+10CO₂↑+8H₂O
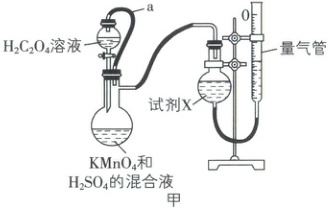
回答下列问题:
(1)橡皮管a除可以避免液体滴加引起气体体积测量误差外,另一个作用是
(2)试剂X为
Ⅱ. 乙同学设计如下实验探究外界条件对化学反应速率的影响。
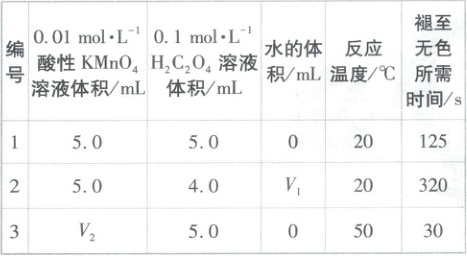
(3)V₁=
(4)0~30s内,实验3用H₂C₂O₄表示的反应速率为
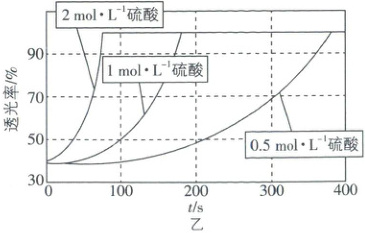
(5)研究发现KMnO₄溶液的酸化程度对反应的速率也有较大影响,其他条件相同,用不同浓度的硫酸进行酸化,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图乙所示,由此得出的结论是
Ⅰ. 甲同学利用图甲所示装置测定化学反应速率。
已知:2MnO₄⁻+5H₂C₂O₄+6H⁺=2Mn²⁺+10CO₂↑+8H₂O

回答下列问题:
(1)橡皮管a除可以避免液体滴加引起气体体积测量误差外,另一个作用是
平衡气压使液体顺利滴下
。(2)试剂X为
NaHCO₃
(填化学式)溶液;实验结束后的操作:ⅰ. 恢复至室温;ⅱ. ……,视线与量气管凹液面最低处相平,读取数据。“……”处的操作为上下移动量气管,使左右两边液面相平
。Ⅱ. 乙同学设计如下实验探究外界条件对化学反应速率的影响。

(3)V₁=
1.0
,实验1、3探究的是反应温度
对反应速率的影响。(4)0~30s内,实验3用H₂C₂O₄表示的反应速率为
0.025
mol·L⁻¹·min⁻¹。(5)研究发现KMnO₄溶液的酸化程度对反应的速率也有较大影响,其他条件相同,用不同浓度的硫酸进行酸化,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图乙所示,由此得出的结论是
在一定范围内,硫酸的浓度越大,化学反应速率越快
。
答案:
7.
(1)平衡气压使液体顺利滴下
(2)NaHCO₃上下移动量气管,使左右两边液面相平
(3)1.0反应温度
(4)0.025
(5)在一定范围内,硫酸的浓度越大,化学反应速率越快
思路导引Ⅰ.酸性KMnO₄溶液具有强氧化性,能够与具有强还原性的H₂C₂O₄发生氧化还原反应:2KMnO₄+
5H₂C₂O₄+3H₂SO₄══2MnSO₄+10CO₂↑+K₂SO₄+8H₂O,
用量气管测定一定时间内反应产生的CO₂气体体积计算反应速率。
Ⅱ.由题表中数据知,该探究实验根据KMnO₄溶液褪色时间判断化学反应速率的快慢。
7.
(1)橡皮管a连通分液漏斗和蒸馏烧瓶,由分液漏斗向蒸馏烧瓶滴加液体时,会有等体积气体通过橡皮管a进入分液漏斗,从而可以避免液体滴加引起气体体积测量误差,同时平衡气压使液体顺利滴下。
(2)二氧化碳不溶于饱和NaHCO₃溶液,可通过排饱和NaHCO₃溶液的方法收集CO₂,则试剂X为饱和NaHCO₃溶液;反应前后,装置内的气体应处于同温同压下,则实验结束后,先恢复到室温,再上下移动量气管、使左右两边液面相平,然后视线与凹液面的最低处相平,读取数据。
(3)实验1、2探究草酸溶液的浓度对化学反应速率的影响,根据实验1可知溶液的总体积V=5.0mL+5.0mL=10.0mL,则V₁=10.0-5.0-4.0=1.0,V₂=10.0-5.0=5.0;实验1、3中除了反应温度不同,其余条件均相同,则探究的是反应温度对反应速率的影响。
(4)溶液褪至无色时,KMnO₄已完全反应,用时30s,KMnO₄溶液的初始浓度为$c(KMnO₄)=\frac{0.01mol·L⁻¹×5.0mL}{10.0mL}=$
0.005mol·L⁻¹,则用KMnO₄溶液的浓度变化表示的化学反应速率$v(KMnO₄)=\frac{0.005mol·L⁻¹}{0.5min}=0.010mol·L⁻¹·min⁻¹,$用
H₂C₂O₄表示的化学反应速率$v(H₂C₂O₄)=\frac{5}{2}v(KMnO₄)=$
0.025mol·L⁻¹·min⁻¹。
(5)由图乙可知,在一定范围内,硫酸的浓度越大,达到相同透光率所需的时间越短,表明反应速率越快。
(1)平衡气压使液体顺利滴下
(2)NaHCO₃上下移动量气管,使左右两边液面相平
(3)1.0反应温度
(4)0.025
(5)在一定范围内,硫酸的浓度越大,化学反应速率越快
思路导引Ⅰ.酸性KMnO₄溶液具有强氧化性,能够与具有强还原性的H₂C₂O₄发生氧化还原反应:2KMnO₄+
5H₂C₂O₄+3H₂SO₄══2MnSO₄+10CO₂↑+K₂SO₄+8H₂O,
用量气管测定一定时间内反应产生的CO₂气体体积计算反应速率。
Ⅱ.由题表中数据知,该探究实验根据KMnO₄溶液褪色时间判断化学反应速率的快慢。
7.
(1)橡皮管a连通分液漏斗和蒸馏烧瓶,由分液漏斗向蒸馏烧瓶滴加液体时,会有等体积气体通过橡皮管a进入分液漏斗,从而可以避免液体滴加引起气体体积测量误差,同时平衡气压使液体顺利滴下。
(2)二氧化碳不溶于饱和NaHCO₃溶液,可通过排饱和NaHCO₃溶液的方法收集CO₂,则试剂X为饱和NaHCO₃溶液;反应前后,装置内的气体应处于同温同压下,则实验结束后,先恢复到室温,再上下移动量气管、使左右两边液面相平,然后视线与凹液面的最低处相平,读取数据。
(3)实验1、2探究草酸溶液的浓度对化学反应速率的影响,根据实验1可知溶液的总体积V=5.0mL+5.0mL=10.0mL,则V₁=10.0-5.0-4.0=1.0,V₂=10.0-5.0=5.0;实验1、3中除了反应温度不同,其余条件均相同,则探究的是反应温度对反应速率的影响。
(4)溶液褪至无色时,KMnO₄已完全反应,用时30s,KMnO₄溶液的初始浓度为$c(KMnO₄)=\frac{0.01mol·L⁻¹×5.0mL}{10.0mL}=$
0.005mol·L⁻¹,则用KMnO₄溶液的浓度变化表示的化学反应速率$v(KMnO₄)=\frac{0.005mol·L⁻¹}{0.5min}=0.010mol·L⁻¹·min⁻¹,$用
H₂C₂O₄表示的化学反应速率$v(H₂C₂O₄)=\frac{5}{2}v(KMnO₄)=$
0.025mol·L⁻¹·min⁻¹。
(5)由图乙可知,在一定范围内,硫酸的浓度越大,达到相同透光率所需的时间越短,表明反应速率越快。
8. [湖南长沙2024高一月考]I⁻可以作为水溶液中SO₂歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO₂+4I⁻+4H⁺=S↓+2I₂+2H₂O;
ⅱ. I₂+2H₂O+SO₂=SO₄²⁻+4H⁺+2I⁻。
为探究ⅰ、ⅱ反应速率与SO₂歧化反应速率的关系,进行如下实验:分别将18mL SO₂饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I₂易溶解在KI溶液中)。
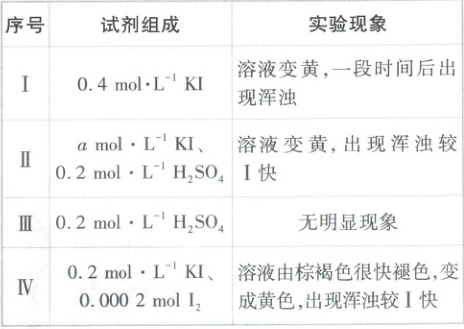
下列说法不正确的是(
A.水溶液中SO₂歧化反应的化学方程式为3SO₂+2H₂O⇌S↓+2H₂SO₄
B.Ⅱ是Ⅰ的对比实验,则a=0.4
C.比较Ⅰ、Ⅱ、Ⅲ可得出结论:I⁻是SO₂歧化反应的催化剂,H⁺单独存在时不具有催化作用,但有I⁻存在时H⁺可以加快SO₂歧化反应的速率
D.实验表明,SO₂的歧化反应速率:Ⅳ>Ⅰ,原因是反应ⅰ比ⅱ快,Ⅳ中由反应ⅱ产生的H⁺使反应ⅰ加快
ⅰ. SO₂+4I⁻+4H⁺=S↓+2I₂+2H₂O;
ⅱ. I₂+2H₂O+SO₂=SO₄²⁻+4H⁺+2I⁻。
为探究ⅰ、ⅱ反应速率与SO₂歧化反应速率的关系,进行如下实验:分别将18mL SO₂饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I₂易溶解在KI溶液中)。

下列说法不正确的是(
D
)A.水溶液中SO₂歧化反应的化学方程式为3SO₂+2H₂O⇌S↓+2H₂SO₄
B.Ⅱ是Ⅰ的对比实验,则a=0.4
C.比较Ⅰ、Ⅱ、Ⅲ可得出结论:I⁻是SO₂歧化反应的催化剂,H⁺单独存在时不具有催化作用,但有I⁻存在时H⁺可以加快SO₂歧化反应的速率
D.实验表明,SO₂的歧化反应速率:Ⅳ>Ⅰ,原因是反应ⅰ比ⅱ快,Ⅳ中由反应ⅱ产生的H⁺使反应ⅰ加快
答案:
8.D【解析】I⁻为催化剂,将ⅰ+ⅱ×2消去I⁻、I₂,可得反应的化学方程式:$3SO₂+2H₂O\frac{\underline{I^-}}{=}S↓+2H₂SO₄,$A正确;Ⅱ是I的对比实验,所用c(KI)应该相等,否则无法得出正确结论,故a=0.4,B正确;比较Ⅰ、Ⅱ、Ⅲ可得出结论:I⁻是SO₂歧化反应的催化剂,H⁺单独存在时不具有催化作用,但有I⁻存在时H⁺可以加快SO₂歧化反应的速率,C正确;实验表明,SO₂的歧化反应速率:Ⅳ>I,结合I、Ⅱ反应速率不同的原因(氢离子使反应速率加快),可知Ⅳ中由反应ⅱ产生的氢离子使反应速率加快,反应ⅱ比ⅰ快,D错误。
查看更多完整答案,请扫码查看


