2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
6. [广东 2021·14,4 分]反应${X\xlongequal{}2Z}$经历两步:①${X\to Y}$;②${Y\to 2Z}$。反应体系中${X}$、${Y}$、${Z}$的浓度$c$随时间$t$的变化曲线如图所示。下列说法不正确的是 (

A.a 为$c({X})$随$t$的变化曲线
B.$t_{1}$时,$c({X})=c({Y})=c({Z})$
C.$t_{2}$时,${Y}$的消耗速率大于生成速率
D.$t_{3}$后,$c({Z})=2c_{0}-c({Y})$
D
)
A.a 为$c({X})$随$t$的变化曲线
B.$t_{1}$时,$c({X})=c({Y})=c({Z})$
C.$t_{2}$时,${Y}$的消耗速率大于生成速率
D.$t_{3}$后,$c({Z})=2c_{0}-c({Y})$
答案:
6.D【解析】由于X=2Z反应分①X→Y和②Y→2Z两步进行,随着不断反应,X的浓度逐渐减小,Y的浓度先增加后减小,Z的浓度逐渐增大,可知a表示c(X)随t的变化曲线,A项正确;$t_{1}$时,图像中三条曲线相交在同一点,即三者的物质的量浓度相等,B项正确;$t_{2}$时Y的物质的量浓度在减小,说明Y的消耗速率大于生成速率,C项正确;从图像中看出$t_{3}$后,X的浓度为0,若全生成Z,则$c(Z)=2c_{0},$体系中存在一定量Y,根据②反应可知,体系中$c(Z)=2c_{0}-2c(Y),$D项错误。
7. [黑吉辽蒙 2025·13,3 分]一种基于${Cu_{2}O}$的储氯电池装置如图,放电过程中 a、b 极均增重。若将 b 极换成${Ag/AgCl}$电极,b 极仍增重。关于图中装置所示电池,下列说法错误的是 (

A.放电时${Na^{+}}$向 b 极迁移
B.该电池可用于海水脱盐
C.a 极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-}\xlongequal{}Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以${Ag/AgCl}$电极代替 a 极,电池将失去储氯能力
D
)
A.放电时${Na^{+}}$向 b 极迁移
B.该电池可用于海水脱盐
C.a 极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-}\xlongequal{}Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以${Ag/AgCl}$电极代替 a 极,电池将失去储氯能力
答案:
7.D
思路导引该装置为原电池。由放电过程中两极均增重可知a极上$Cu_{2}O$失去电子发生氧化反应生成$Cu_{2}(OH)_{3}Cl,$则a极为负极;b极上$NaTi_{2}(PO_{4})_{3}$得到电子发生还原反应生成$Na_{3}Ti_{2}(PO_{4})_{3},$则b极为正极。
定位电极及反应类型电极反应式
a极(负极),氧化反应$Cu_{2}O + 2H_{2}O-2e^{-}+Cl^{-}=Cu_{2}(OH)_{3}Cl+H^{+}$
b极(正极),还原反应$NaTi_{2}(PO_{4})_{3}+2e^{-}+2Na^{+}=Na_{3}Ti_{2}(PO_{4})_{3}$
【解析】放电时阳离子$(Na^{+})$向正极(b极)迁移,A正确;该电池负极消耗$Cl^{-}、$正极消耗$Na^{+},$所以可用于海水脱盐,B正确;根据思路导引可知,C正确;由原电池电极反应可知还原性:$Cu_{2}O>NaTi_{2}(PO_{4})_{3},$而将b极换为Ag/AgCl电极后b极仍增重,则此时b极电极反应式为$Ag-e^{-}+Cl^{-}=AgCl,$所以该电极作为负极,则还原性:$Ag>Cu_{2}O,$综合可知还原性:$Ag>Cu_{2}O>NaTi_{2}(PO_{4})_{3},$若以Ag/AgCl电极代替a极,则a极电极反应式为$Ag-e^{-}+Cl^{-}=AgCl、$b极电极反应式为$NaTi_{2}(PO_{4})_{3}+2e^{-}+2Na^{+}=Na_{3}Ti_{2}(PO_{4})_{3},$电池不会失去储氯能力,D错误。
思路导引该装置为原电池。由放电过程中两极均增重可知a极上$Cu_{2}O$失去电子发生氧化反应生成$Cu_{2}(OH)_{3}Cl,$则a极为负极;b极上$NaTi_{2}(PO_{4})_{3}$得到电子发生还原反应生成$Na_{3}Ti_{2}(PO_{4})_{3},$则b极为正极。
定位电极及反应类型电极反应式
a极(负极),氧化反应$Cu_{2}O + 2H_{2}O-2e^{-}+Cl^{-}=Cu_{2}(OH)_{3}Cl+H^{+}$
b极(正极),还原反应$NaTi_{2}(PO_{4})_{3}+2e^{-}+2Na^{+}=Na_{3}Ti_{2}(PO_{4})_{3}$
【解析】放电时阳离子$(Na^{+})$向正极(b极)迁移,A正确;该电池负极消耗$Cl^{-}、$正极消耗$Na^{+},$所以可用于海水脱盐,B正确;根据思路导引可知,C正确;由原电池电极反应可知还原性:$Cu_{2}O>NaTi_{2}(PO_{4})_{3},$而将b极换为Ag/AgCl电极后b极仍增重,则此时b极电极反应式为$Ag-e^{-}+Cl^{-}=AgCl,$所以该电极作为负极,则还原性:$Ag>Cu_{2}O,$综合可知还原性:$Ag>Cu_{2}O>NaTi_{2}(PO_{4})_{3},$若以Ag/AgCl电极代替a极,则a极电极反应式为$Ag-e^{-}+Cl^{-}=AgCl、$b极电极反应式为$NaTi_{2}(PO_{4})_{3}+2e^{-}+2Na^{+}=Na_{3}Ti_{2}(PO_{4})_{3},$电池不会失去储氯能力,D错误。
8. [重庆 2025·17 节选]用如图所示电化学装置进行如下实验。
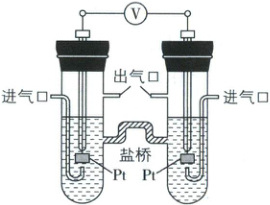
(1)用${H_{2}}$实验:在左侧通入${H_{2}}$,产物为${H_{2}O}$,盐桥中${K^{+}}$移向装置的
(2)用${O_{2}}$实验:在一侧通入${O_{2}}$,电池的总反应仍保持不变,该侧的电极反应为

(1)用${H_{2}}$实验:在左侧通入${H_{2}}$,产物为${H_{2}O}$,盐桥中${K^{+}}$移向装置的
右侧
(填“左侧”或“右侧”),电池的总反应为2H₂+O₂=2H₂O
。(2)用${O_{2}}$实验:在一侧通入${O_{2}}$,电池的总反应仍保持不变,该侧的电极反应为
O₂+4e⁻+2H₂O=4OH⁻
。
答案:
8.
(1)右侧$2H_{2}+O_{2}=2H_{2}O$
$(2)O_{2}+4e^{-}+2H_{2}O=4OH^{-}$
【解析】
(1)用$H_{2}$进行实验,燃料电池中通入$H_{2}$的电极失电子生成$H_{2}O$:$H_{2}-2e^{-}+2OH^{-}=2H_{2}O,$该极为负极,在原电池中,阳离子向正极移动,所以盐桥中$K^{+}$移向正极,即右侧,氢氧燃料电池总反应为$2H_{2}+O_{2}=2H_{2}O。$
(2)用$O_{2}$进行实验,$O_{2}$得电子,该电极为正极,电池总反应不变,即该电池仍是氢氧燃料电池,则通入$O_{2}$一侧电极反应式为$O_{2}+4e^{-}+2H_{2}O=4OH^{-}。$
(1)右侧$2H_{2}+O_{2}=2H_{2}O$
$(2)O_{2}+4e^{-}+2H_{2}O=4OH^{-}$
【解析】
(1)用$H_{2}$进行实验,燃料电池中通入$H_{2}$的电极失电子生成$H_{2}O$:$H_{2}-2e^{-}+2OH^{-}=2H_{2}O,$该极为负极,在原电池中,阳离子向正极移动,所以盐桥中$K^{+}$移向正极,即右侧,氢氧燃料电池总反应为$2H_{2}+O_{2}=2H_{2}O。$
(2)用$O_{2}$进行实验,$O_{2}$得电子,该电极为正极,电池总反应不变,即该电池仍是氢氧燃料电池,则通入$O_{2}$一侧电极反应式为$O_{2}+4e^{-}+2H_{2}O=4OH^{-}。$
1. 某小组同学设计了如下原电池装置,下列有关说法中不正确的是 (
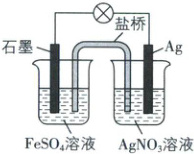
A.该装置将化学能转化为电能
B.该电池盐桥中的溶质不能是${KCl}$
C.石墨电极的电势小于${Ag}$电极
D.${Ag}$电极的电极反应式为${Ag - e^{-}\xlongequal{}Ag^{+}}$
D
)
A.该装置将化学能转化为电能
B.该电池盐桥中的溶质不能是${KCl}$
C.石墨电极的电势小于${Ag}$电极
D.${Ag}$电极的电极反应式为${Ag - e^{-}\xlongequal{}Ag^{+}}$
答案:
1.D【解析】该装置为原电池装置,可将化学能转化为电能,A正确;由图可知,该电池的反应原理为$Fe^{2+}+Ag^{+}=Fe^{3+}+Ag,$故石墨电极作负极,电极反应式为$Fe^{2+}-e^{-}=Fe^{3+},$银电极作正极,电极反应式为$Ag^{+}+e^{-}=Ag,$故石墨电极的电势小于Ag电极,C正确,D错误;若盐桥中添加的溶质为KCl,会与右侧烧杯中的硝酸银溶液发生反应生成AgCl沉淀,银电极反应不能正常进行,形成断路,B正确。
2. 如图为某校在竞赛中获奖的新能源小车电池示意图,请回答下列问题:
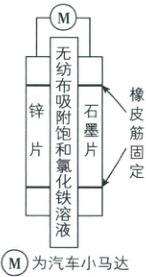
(1)正极上发生的反应为____(填“氧化”或“还原”)反应,电极反应式为____。
(2)电池总反应为
(3)电子由
(4)一段时间后,发现电池有发热情况,说明有部分化学能转化为
(5)假设电池运行 5 分钟,${Fe^{3+}}$的物质的量减少 0.01 mol,则负极减少的质量为
(6)一段时间后,发现锌片上有铁附着,可能发生的反应方程式为

(1)正极上发生的反应为____(填“氧化”或“还原”)反应,电极反应式为____。
(2)电池总反应为
Zn+2Fe³⁺=2Fe²⁺+Zn²⁺
。(3)电子由
锌片
经外电路
流向石墨片
。(4)一段时间后,发现电池有发热情况,说明有部分化学能转化为
热
能。(5)假设电池运行 5 分钟,${Fe^{3+}}$的物质的量减少 0.01 mol,则负极减少的质量为
0.325g
。(6)一段时间后,发现锌片上有铁附着,可能发生的反应方程式为
Fe²⁺+Zn=Fe+Zn²⁺
。
答案:
2.
(1)还原$Fe^{3+}+e^{-}=Fe^{2+}$
$(2)Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+}$
(3)锌片外电路石墨片
(4)热
$(5)0.325g(6)Fe^{2+}+Zn=Fe+Zn^{2+}$
【解析】
(1)石墨片作正极,锌片作负极,$Fe^{3+}$在正极上得电子,发生还原反应生成$Fe^{2+}。$
(2)电池总反应为$Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+}。$
(3)锌失去电子生成$Zn^{2+},$电子经过导线流向汽车小马达,再经导线流向石墨片,石墨片上$Fe^{3+}$得电子生成$Fe^{2+},$故电子由锌片经外电路流向石墨片。
(4)电池有发热情况,说明有部分化学能转化为热能。
$(5)Fe^{3+}$的物质的量减少0.01mol,根据电池总反应$Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+},$有0.005molZn发生反应,即负极减少的质量为$0.005mol×65g·mol^{-1}=0.325g。$
(6)正极$Fe^{3+}$得电子生成的$Fe^{2+}$可能移动到负极,与锌片接触,发生置换反应生成铁单质,反应方程式为$Fe^{2+}+Zn=Fe+Zn^{2+}。$
(1)还原$Fe^{3+}+e^{-}=Fe^{2+}$
$(2)Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+}$
(3)锌片外电路石墨片
(4)热
$(5)0.325g(6)Fe^{2+}+Zn=Fe+Zn^{2+}$
【解析】
(1)石墨片作正极,锌片作负极,$Fe^{3+}$在正极上得电子,发生还原反应生成$Fe^{2+}。$
(2)电池总反应为$Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+}。$
(3)锌失去电子生成$Zn^{2+},$电子经过导线流向汽车小马达,再经导线流向石墨片,石墨片上$Fe^{3+}$得电子生成$Fe^{2+},$故电子由锌片经外电路流向石墨片。
(4)电池有发热情况,说明有部分化学能转化为热能。
$(5)Fe^{3+}$的物质的量减少0.01mol,根据电池总反应$Zn+2Fe^{3+}=2Fe^{2+}+Zn^{2+},$有0.005molZn发生反应,即负极减少的质量为$0.005mol×65g·mol^{-1}=0.325g。$
(6)正极$Fe^{3+}$得电子生成的$Fe^{2+}$可能移动到负极,与锌片接触,发生置换反应生成铁单质,反应方程式为$Fe^{2+}+Zn=Fe+Zn^{2+}。$
查看更多完整答案,请扫码查看


