2026年江苏13大市中考名卷优选38套化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年江苏13大市中考名卷优选38套化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第35页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
9. (2023南通)(7分)实验室以软锰矿(主要含${MnO_{2}}$的矿石)为原料制备${MnO_{2}}$的流程如下:
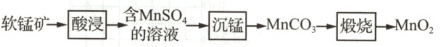
(1)${MnO_{2}}$催化分解${KClO_{3}}$的化学反应方程式为
(2)“酸浸”时,为使软锰矿充分反应,可采取的措施有
(3)“沉锰”反应为${MnSO_{4} + 2NH_{4}HCO_{3}\xlongequal{\triangle}MnCO_{3}\downarrow + (NH_{4})_{2}SO_{4} + H_{2}O + CO_{2}\uparrow}$。加热温度不能过高的原因是
(4)在空气中“煅烧”${MnCO_{3}}$会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。

①${370~410\ {^{\circ}C}}$发生的主要反应为${2MnO + O_{2}\xlongequal{\triangle}2MnO_{2}}$。该反应属于基本反应类型中的
②已知酒精灯外焰的最高温度可达${600\ {^{\circ}C}}$。称取一定质量的${MnO_{2}}$,与${KClO_{3}}$混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。${MnO_{2}}$质量减少的主要原因是

(1)${MnO_{2}}$催化分解${KClO_{3}}$的化学反应方程式为
2KClO₃ → 2KCl + 3O₂↑
。(2)“酸浸”时,为使软锰矿充分反应,可采取的措施有
搅拌(或粉碎、加热、适当提高酸的浓度等)
(写一条)。(3)“沉锰”反应为${MnSO_{4} + 2NH_{4}HCO_{3}\xlongequal{\triangle}MnCO_{3}\downarrow + (NH_{4})_{2}SO_{4} + H_{2}O + CO_{2}\uparrow}$。加热温度不能过高的原因是
防止NH₄HCO₃分解
。(4)在空气中“煅烧”${MnCO_{3}}$会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。

①${370~410\ {^{\circ}C}}$发生的主要反应为${2MnO + O_{2}\xlongequal{\triangle}2MnO_{2}}$。该反应属于基本反应类型中的
化合
反应。②已知酒精灯外焰的最高温度可达${600\ {^{\circ}C}}$。称取一定质量的${MnO_{2}}$,与${KClO_{3}}$混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。${MnO_{2}}$质量减少的主要原因是
温度高于450℃时,MnO₂会分解成Mn₂O₃,该过程中固体质量减少
。
答案:
9.
(1)$2 KClO_3 \xlongequal[\triangle]{ MnO_2} 2 KCl + 3 O_2 \uparrow$
(2)搅拌(或粉碎、加热、适当提高酸的浓度等)
(3)防止$ NH_4 HCO_3$分解
(4)①化合 ②温度高于$450\ ^{\circ} C$时,$ MnO_2$会分解成$ Mn_2 O_3$,该过程中固体质量减少。
(1)$2 KClO_3 \xlongequal[\triangle]{ MnO_2} 2 KCl + 3 O_2 \uparrow$
(2)搅拌(或粉碎、加热、适当提高酸的浓度等)
(3)防止$ NH_4 HCO_3$分解
(4)①化合 ②温度高于$450\ ^{\circ} C$时,$ MnO_2$会分解成$ Mn_2 O_3$,该过程中固体质量减少。
10. (2023无锡)(8分)由菱铁矿(主要成分为${FeCO_{3}}$,含少量${SiO_{2}}$等杂质)制备铁粉的一种流程如图所示。

(1)碳酸亚铁(${FeCO_{3}}$)中铁元素的化合价为
(2)“酸浸”时,为使反应充分,可采取的一种措施是
(3)“沉铁”时,${FeSO_{4}}$转化为${FeCO_{3}}$沉淀,该反应的基本类型是
(4)“还原”时,在高温条件下,利用炭粉可将铁从氧化铁中还原出来;若向氧化铁与炭粉的混合物中添加适量的${CaCO_{3}}$,更利于还原氧化铁,其原因是

(1)碳酸亚铁(${FeCO_{3}}$)中铁元素的化合价为
+2
。(2)“酸浸”时,为使反应充分,可采取的一种措施是
将菱铁矿粉碎(合理即可)
。“酸浸”后所得溶液中含有的溶质:${FeSO_{4}}$和H₂SO₄
。(3)“沉铁”时,${FeSO_{4}}$转化为${FeCO_{3}}$沉淀,该反应的基本类型是
复分解反应
。“焙烧”时,在高温条件下,${FeCO_{3}}$与${O_{2}}$反应生成${Fe_{2}O_{3}}$与${CO_{2}}$的化学方程式为4FeCO₃ + O₂ → 2Fe₂O₃ + 4CO₂
。(4)“还原”时,在高温条件下,利用炭粉可将铁从氧化铁中还原出来;若向氧化铁与炭粉的混合物中添加适量的${CaCO_{3}}$,更利于还原氧化铁,其原因是
碳酸钙高温分解生成二氧化碳,二氧化碳能与碳反应生成一氧化碳,一氧化碳可将铁从氧化铁中还原出来
。
答案:
10.
(1)+2
(2)将菱铁矿粉碎(合理即可) $ H_2 SO_4$
(3)复分解反应 $4 FeCO_3 + O_2 \xlongequal{ 高温} 2 Fe_2 O_3 + 4 CO_2$
(4)碳酸钙高温分解生成二氧化碳,二氧化碳能与碳反应生成一氧化碳,一氧化碳可将铁从氧化铁中还原出来
(1)+2
(2)将菱铁矿粉碎(合理即可) $ H_2 SO_4$
(3)复分解反应 $4 FeCO_3 + O_2 \xlongequal{ 高温} 2 Fe_2 O_3 + 4 CO_2$
(4)碳酸钙高温分解生成二氧化碳,二氧化碳能与碳反应生成一氧化碳,一氧化碳可将铁从氧化铁中还原出来
11. (2023苏州)(11分)用蛋壳(主要含${CaCO_{3}}$,还有少量${MgCO_{3}}$和有机物)为原料通过以下步骤制取补钙剂醋酸钙${[(CH_{3}COO)_{2}Ca]}$。

已知:①醋酸钙易溶于水,高于${160\ {^{\circ}C}}$时发生分解;②醋酸(${CH_{3}COOH}$)易挥发。
(1)焙烧。将蛋壳在高温下焙烧后冷却,得到含金属氧化物的固体。
①焙烧过程中,${CaCO_{3}}$发生反应的化学方程式为
②焙烧过程中,产生烧焦羽毛的气味,说明蛋壳中含有
(2)酸溶。在焙烧后的固体中先加入适量水打浆,冷却后,再加入稍过量的醋酸得到醋酸盐溶液。不能向焙烧后的固体中直接加入醋酸的原因是
(3)除镁。在酸溶后的溶液中加入${Ca(OH)_{2}}$至碱性,将${(CH_{3}COO)_{2}Mg}$转化为${Mg(OH)_{2}}$沉淀除去。该反应属于
(4)中和。在除镁后的溶液中加入醋酸调节溶液的$pH$为7。其目的有①将溶液中的少量${Ca(OH)_{2}}$转化为${(CH_{3}COO)_{2}Ca}$;②
(5)将中和后的溶液蒸发浓缩至有大量晶体析出,过滤得到醋酸钙晶体。蒸发时不能直接将溶液蒸干的原因是
(6)醋酸钙高温下分解所得氧化钙可作为气体吸收剂。将${50.0\ {g}\ (CH_{3}COO)_{2}Ca}$质量分数为$94.8\%$的样品在高温下完全分解,计算分解得到$CaO$的质量(写出计算过程)。
已知:①醋酸钙分解反应为${(CH_{3}COO)_{2}Ca\xlongequal{ 高温}CaO + C_{3}H_{6}O\uparrow + CO_{2}\uparrow}$;杂质不发生反应。②${(CH_{3}COO)_{2}Ca}$的相对分子质量为158。

已知:①醋酸钙易溶于水,高于${160\ {^{\circ}C}}$时发生分解;②醋酸(${CH_{3}COOH}$)易挥发。
(1)焙烧。将蛋壳在高温下焙烧后冷却,得到含金属氧化物的固体。
①焙烧过程中,${CaCO_{3}}$发生反应的化学方程式为
CaCO₃ → CaO + CO₂↑
。②焙烧过程中,产生烧焦羽毛的气味,说明蛋壳中含有
蛋白质
(填有机物名称)。(2)酸溶。在焙烧后的固体中先加入适量水打浆,冷却后,再加入稍过量的醋酸得到醋酸盐溶液。不能向焙烧后的固体中直接加入醋酸的原因是
焙烧后的固体为氧化钙,若向氧化钙固体中加入醋酸,氧化钙与水反应放热,会加速醋酸的挥发
。(3)除镁。在酸溶后的溶液中加入${Ca(OH)_{2}}$至碱性,将${(CH_{3}COO)_{2}Mg}$转化为${Mg(OH)_{2}}$沉淀除去。该反应属于
复分解反应
(填基本反应类型)。(4)中和。在除镁后的溶液中加入醋酸调节溶液的$pH$为7。其目的有①将溶液中的少量${Ca(OH)_{2}}$转化为${(CH_{3}COO)_{2}Ca}$;②
防止溶液吸收空气中的二氧化碳
。(5)将中和后的溶液蒸发浓缩至有大量晶体析出,过滤得到醋酸钙晶体。蒸发时不能直接将溶液蒸干的原因是
防止蒸干时局部温度过高,导致醋酸钙分解
。(6)醋酸钙高温下分解所得氧化钙可作为气体吸收剂。将${50.0\ {g}\ (CH_{3}COO)_{2}Ca}$质量分数为$94.8\%$的样品在高温下完全分解,计算分解得到$CaO$的质量(写出计算过程)。
已知:①醋酸钙分解反应为${(CH_{3}COO)_{2}Ca\xlongequal{ 高温}CaO + C_{3}H_{6}O\uparrow + CO_{2}\uparrow}$;杂质不发生反应。②${(CH_{3}COO)_{2}Ca}$的相对分子质量为158。
答案:
11.
(1)①$ CaCO_3 \xlongequal{ 高温} CaO + CO_2 \uparrow$ ②蛋白质
(2)焙烧后的固体为氧化钙,若向氧化钙固体中加入醋酸,氧化钙与水反应放热,会加速醋酸的挥发
(3)复分解反应
(4)防止溶液吸收空气中的二氧化碳
(5)防止蒸干时局部温度过高,导致醋酸钙分解
(6)解:设分解得到的$ CaO$的质量为$x$。 $( CH_3 COO)_2 Ca \xlongequal{ 高温} CaO + C_3 H_6 O \uparrow + CO_2 \uparrow$ $158 \quad 56$ $50.0\ g × 94.8\% \quad x$ $\frac{158}{56} = \frac{50.0\ g × 94.8\%}{x}$ $x = 16.8\ g$ 答:分解得到$16.8\ g\ CaO$。
(1)①$ CaCO_3 \xlongequal{ 高温} CaO + CO_2 \uparrow$ ②蛋白质
(2)焙烧后的固体为氧化钙,若向氧化钙固体中加入醋酸,氧化钙与水反应放热,会加速醋酸的挥发
(3)复分解反应
(4)防止溶液吸收空气中的二氧化碳
(5)防止蒸干时局部温度过高,导致醋酸钙分解
(6)解:设分解得到的$ CaO$的质量为$x$。 $( CH_3 COO)_2 Ca \xlongequal{ 高温} CaO + C_3 H_6 O \uparrow + CO_2 \uparrow$ $158 \quad 56$ $50.0\ g × 94.8\% \quad x$ $\frac{158}{56} = \frac{50.0\ g × 94.8\%}{x}$ $x = 16.8\ g$ 答:分解得到$16.8\ g\ CaO$。
查看更多完整答案,请扫码查看


