2026年江苏13大市中考名卷优选38套化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年江苏13大市中考名卷优选38套化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
1. (2022苏州)碳酸钠的溶解度曲线如图所示。下列说法正确的是 (
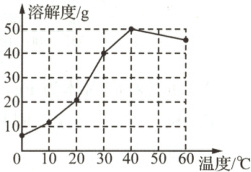
A.碳酸钠的溶解度随温度升高而增大
B.将20 ℃的碳酸钠的饱和溶液升温至30 ℃,溶质质量分数不变
C.30 ℃时,将25 g碳酸钠加入50 g水中,所得溶液质量为75 g
D.40 ℃时,饱和碳酸钠溶液的溶质质量分数为50%
B
)
A.碳酸钠的溶解度随温度升高而增大
B.将20 ℃的碳酸钠的饱和溶液升温至30 ℃,溶质质量分数不变
C.30 ℃时,将25 g碳酸钠加入50 g水中,所得溶液质量为75 g
D.40 ℃时,饱和碳酸钠溶液的溶质质量分数为50%
答案:
1. B 在0~40 ℃,碳酸钠的溶解度随温度升高而增大,40 ℃之后,碳酸钠的溶解度随温度升高而减小;将20 ℃的碳酸钠饱和溶液升温到30 ℃,碳酸钠的溶解度随温度升高而增大,饱和溶液变成不饱和溶液,溶质和溶剂的质量均没有改变,因此溶质质量分数不变;30 ℃时,碳酸钠的溶解度为40 g,故将25 g碳酸钠放入50 g水中,最多只能溶解20 g,形成70 g碳酸钠溶液;40 ℃时,碳酸钠的溶解度为50 g,故此时饱和碳酸钠溶液的溶质质量分数=$\frac{50 g}{50 g+100 g}×100 \% \approx33.3 \%$。
2. (2022镇江)$\mathrm{Na_2CO_3}$和$\mathrm{NH_4HCO_3}$的溶解度曲线如图所示。下列说法正确的是 (

A.$\mathrm{T_3}$℃时,将30 g $\mathrm{Na_2CO_3}$固体加到50 g水中,所得溶液的溶质质量分数为37.5%
B.将$\mathrm{Na_2CO_3}$的饱和溶液从$\mathrm{T_2}$℃升温至$\mathrm{T_4}$℃,溶质质量分数变大
C.将100 g $\mathrm{NH_4HCO_3}$的饱和溶液从$\mathrm{T_4}$℃降温至$\mathrm{T_1}$℃,析出20 g $\mathrm{NH_4HCO_3}$晶体
D.将等质量的两种物质的饱和溶液从$\mathrm{T_1}$℃升温至$\mathrm{T_4}$℃,为使溶液恰好饱和,加入的两种固体质量相等
D
)
A.$\mathrm{T_3}$℃时,将30 g $\mathrm{Na_2CO_3}$固体加到50 g水中,所得溶液的溶质质量分数为37.5%
B.将$\mathrm{Na_2CO_3}$的饱和溶液从$\mathrm{T_2}$℃升温至$\mathrm{T_4}$℃,溶质质量分数变大
C.将100 g $\mathrm{NH_4HCO_3}$的饱和溶液从$\mathrm{T_4}$℃降温至$\mathrm{T_1}$℃,析出20 g $\mathrm{NH_4HCO_3}$晶体
D.将等质量的两种物质的饱和溶液从$\mathrm{T_1}$℃升温至$\mathrm{T_4}$℃,为使溶液恰好饱和,加入的两种固体质量相等
答案:
2. D $T_3$℃时,$Na_2CO_3$的溶解度为50 g,因此将30 g$Na_2CO_3$加入50 g水中只能溶解25 g,得到75 g饱和溶液,溶质质量分数=$\frac{25 g}{75 g}×100 \% \approx33.3 \%$;从$T_2$℃升温到$T_4$℃过程中,$Na_2CO_3$的溶解度先变大后变小,由于在$T_2$℃和$T_4$℃时,$Na_2CO_3$的溶解度相同,所以饱和溶液在整个过程中没有$Na_2CO_3$晶体析出,溶质质量分数保持不变;在$T_1$℃和$T_4$℃时,$NH_4HCO_3$的溶解度相差20 g,只有将142 g饱和$NH_4HCO_3$溶液从$T_4$℃降温到$T_1$℃,才会析出20 g$NH_4HCO_3$。
3. (2022南通)$\mathrm{NH_4Cl}$和$\mathrm{NaCl}$的溶解度曲线如图所示。下列说法正确的是 (
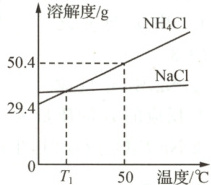
A.$\mathrm{NaCl}$的溶解度一定小于$\mathrm{NH_4Cl}$的溶解度
B.$\mathrm{T_1}$℃时,$\mathrm{NaCl}$、$\mathrm{NH_4Cl}$两饱和溶液中溶质的质量分数相等
C.50 ℃时,将50 g $\mathrm{NH_4Cl}$固体加入50 g水中,充分溶解,所得溶液的质量为100 g
D.将50 ℃时100 g饱和$\mathrm{NH_4Cl}$溶液冷却至0 ℃,析出晶体21 g
B
)
A.$\mathrm{NaCl}$的溶解度一定小于$\mathrm{NH_4Cl}$的溶解度
B.$\mathrm{T_1}$℃时,$\mathrm{NaCl}$、$\mathrm{NH_4Cl}$两饱和溶液中溶质的质量分数相等
C.50 ℃时,将50 g $\mathrm{NH_4Cl}$固体加入50 g水中,充分溶解,所得溶液的质量为100 g
D.将50 ℃时100 g饱和$\mathrm{NH_4Cl}$溶液冷却至0 ℃,析出晶体21 g
答案:
3. B 由题给$NH_4Cl$和$NaCl$的溶解度曲线可知,温度低于$T_1$℃时,$NaCl$的溶解度大于$NH_4Cl$的溶解度,当温度高于$T_1$℃时,$NH_4Cl$的溶解度大于$NaCl$的溶解度;$T_1$℃时,$NaCl$的溶解度等于$NH_4Cl$的溶解度,所以此时$NaCl$、$NH_4Cl$两种饱和溶液中溶质的质量分数相等;50 ℃时,$NH_4Cl$的溶解度为50.4 g,将50 g$NH_4Cl$固体加入50 g水中,充分溶解,所得溶液的质量=$50 g+50.4 g×\frac{50 g}{100 g}$=75.2 g;50 ℃时$NH_4Cl$的溶解度为50.4 g,0 ℃时$NH_4Cl$的溶解度为29.4 g,将50 ℃时150.4 g饱和$NH_4Cl$溶液冷却至0 ℃,析出$NH_4Cl$晶体的质量=50.4 g−29.4 g=21 g,而将50 ℃时100 g饱和$NH_4Cl$溶液冷却至0 ℃,析出$NH_4Cl$晶体的质量一定小于21 g。
4. (2022扬州)$\mathrm{KNO_3}$与$\mathrm{KCl}$的溶解度曲线如图所示。下列说法正确的是 (

A.10 ℃时,$\mathrm{KNO_3}$的溶解度比$\mathrm{KCl}$大
B.$\mathrm{KCl}$的溶解度受温度影响的程度比$\mathrm{KNO_3}$大
C.60 ℃时,P点表示的$\mathrm{KNO_3}$溶液还能继续溶解$\mathrm{KNO_3}$固体
D.将60 ℃的饱和$\mathrm{KCl}$溶液降温至10 ℃,溶液中溶质质量分数不变
C
)
A.10 ℃时,$\mathrm{KNO_3}$的溶解度比$\mathrm{KCl}$大
B.$\mathrm{KCl}$的溶解度受温度影响的程度比$\mathrm{KNO_3}$大
C.60 ℃时,P点表示的$\mathrm{KNO_3}$溶液还能继续溶解$\mathrm{KNO_3}$固体
D.将60 ℃的饱和$\mathrm{KCl}$溶液降温至10 ℃,溶液中溶质质量分数不变
答案:
4. C 10 ℃时,硝酸钾的溶解度小于氯化钾的溶解度;根据两条溶解度曲线的斜率可知,硝酸钾的溶解度受温度影响的程度比氯化钾的大;60 ℃时,P点是硝酸钾溶解度曲线下方的点,为60 ℃时硝酸钾的不饱和溶液,还能继续溶解硝酸钾固体;氯化钾的溶解度随温度的升高而增大,将60 ℃时氯化钾的饱和溶液降温至10 ℃,溶解度减小,有溶质析出,溶质质量分数变小。
5. (2022宿迁)“侯氏制碱法”创立了更先进的“制碱”工艺,主要反应是$\mathrm{NaCl + NH_4HCO_3 \xlongequal{ } NaHCO_3↓+NH_4Cl}$。如图是三种物质的溶解度曲线,下列叙述正确的是 (

A.0 ℃时,$\mathrm{NH_4Cl}$的溶解度大于$\mathrm{NaCl}$的溶解度
B.$\mathrm{NH_4Cl}$中含有少量$\mathrm{NaCl}$,可用降温结晶的方法提纯$\mathrm{NH_4Cl}$
C.20 ℃时,$\mathrm{NaHCO_3}$饱和溶液的溶质质量分数一定大于$\mathrm{NH_4Cl}$不饱和溶液的溶质质量分数
D.20 ℃时,将9.6 g $\mathrm{NaHCO_3}$加入90.4 g水中,可得到100 g饱和溶液
B
)
A.0 ℃时,$\mathrm{NH_4Cl}$的溶解度大于$\mathrm{NaCl}$的溶解度
B.$\mathrm{NH_4Cl}$中含有少量$\mathrm{NaCl}$,可用降温结晶的方法提纯$\mathrm{NH_4Cl}$
C.20 ℃时,$\mathrm{NaHCO_3}$饱和溶液的溶质质量分数一定大于$\mathrm{NH_4Cl}$不饱和溶液的溶质质量分数
D.20 ℃时,将9.6 g $\mathrm{NaHCO_3}$加入90.4 g水中,可得到100 g饱和溶液
答案:
5. B 据图可知,0 ℃时$NH_4Cl$的溶解度小于$NaCl$的溶解度;$NH_4Cl$的溶解度受温度影响较大,$NaCl$的溶解度受温度影响较小,当$NH_4Cl$中含有少量$NaCl$时,可用降温结晶的方法提纯$NH_4Cl$;20 ℃时,$NaHCO_3$的溶解度小于$NH_4Cl$的溶解度,故$NaHCO_3$饱和溶液的溶质质量分数不一定大于$NH_4Cl$不饱和溶液的溶质质量分数;20 ℃时,$NaHCO_3$的溶解度为9.6 g,说明该温度下100 g水中最多溶解9.6 g$NaHCO_3$,将9.6 g$NaHCO_3$加入90.4 g水中,不能完全溶解,不能得到100 g饱和溶液。
查看更多完整答案,请扫码查看


