2026年江苏13大市中考名卷优选38套化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年江苏13大市中考名卷优选38套化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第139页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
19 向$NaOH$稀溶液中缓缓通入$HCl$气体,该过程溶液导电能力的变化如图所示(溶液体积、温度的变化可忽略)。下列说法错误的是 (

A.该反应的实质是${H^{+}}$和${OH^{-}}$结合成${H_{2}O}$
B.$A$点到$B$点导电能力减小是因为溶液中离子数量逐渐减少
C.$B$点时$NaOH$与$HCl$恰好完全反应
D.分析$B\rightarrow C$段变化,可推测溶液的导电能力除了与离子种类有关,还与离子浓度有关
B
)
A.该反应的实质是${H^{+}}$和${OH^{-}}$结合成${H_{2}O}$
B.$A$点到$B$点导电能力减小是因为溶液中离子数量逐渐减少
C.$B$点时$NaOH$与$HCl$恰好完全反应
D.分析$B\rightarrow C$段变化,可推测溶液的导电能力除了与离子种类有关,还与离子浓度有关
答案:
19.B 该反应是中和反应,实质是H⁺和OH⁻结合成H₂O,A正确;A点到B点发生的反应为HCl + NaOH = NaCl + H₂O,溶液中减少的OH⁻数目和增加的Cl⁻数目相等,溶液中离子数量不变,题中已说明溶液体积变化忽略不计,故A点到B点导电能力减小的原因可能是离子种类变化,B错误;B点时导电能力最小,NaOH与HCl恰好完全反应,C正确;C点后,继续通入HCl气体,溶液中离子(H⁺、Cl⁻)数目增加,但溶液体积不变,B→C段导电能力增加,说明溶液的导电能力除了与离子种类有关,还与离子的浓度有关,D正确。
20 现有一包由$2.4\ {g}$镁、$6.5\ {g}$锌、$1.6\ {g}$碳混合而成的粉末,把它加入一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣中含有三种物质。则滤渣的质量可能是 (
A.$10.5\ {g}$
B.$35.6\ {g}$
C.$44.8\ {g}$
D.$65.8\ {g}$
B
)A.$10.5\ {g}$
B.$35.6\ {g}$
C.$44.8\ {g}$
D.$65.8\ {g}$
答案:
20.B 已知滤渣中含有三种物质,结合金属活动性推知,该三种物质只能是Zn、C、Ag,则Mg一定反应完,Zn可能部分发生反应。由关系式:Mg~2Ag知,2.4gMg完全反应时置换出的m₁(Ag)=2.4g×$\frac{108×2}{24}$ = 21.6g,由关系式:Zn~2Ag知,6.5gZn完全反应时置换出的m₂(Ag)=6.5g×$\frac{108×2}{65}$ = 21.6g,C的质量为1.6g,则1.6g + 21.6g + 6.5g≤滤渣的质量<1.6g + 21.6g + 21.6g,即29.7g≤滤渣的质量<44.8g,故选B。
Plus关键点拨
利用极限假设法解题
本题要注意金属的活动性顺序和单质碳在常温下的不活泼性。由于镁、锌都能与硝酸银反应,因此在分析滤渣成分时可采用极限假设的方法进行分析。
Plus关键点拨
利用极限假设法解题
本题要注意金属的活动性顺序和单质碳在常温下的不活泼性。由于镁、锌都能与硝酸银反应,因此在分析滤渣成分时可采用极限假设的方法进行分析。
21 (10分)化学生活、生产和科技发展中发挥着重要作用。完成下面小题。
(1)典籍中的化学
《天工开物》被誉为“中国17世纪工艺百科全书”,其中描述了锡的冶炼方法,如图。

①炼锡时混入少许铅形成合金,产物更易熔化流出,原因是
a. 增强硬度
b. 降低熔点
c. 增强抗腐蚀性
②锡砂中的${SnO_{2}}$与木炭在高温下反应生成锡和二氧化碳,化学方程式为
(2)生活中的化学
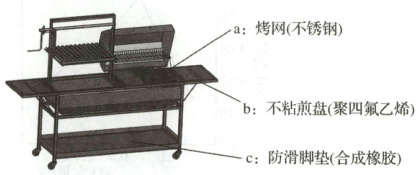
①如图为某品牌烧烤架,图中属于合成材料的是
②将鸡翅用铝箔包好进行烤制,过程中体现了铝箔具有良好的
③小明烤制了下列食物,其中富含维生素的是
a. 鱼
b. 鸡翅
c. 韭菜
(3)科技中的化学
银-锌纽扣电池可做太空微型电源,如图是其构造示意图。
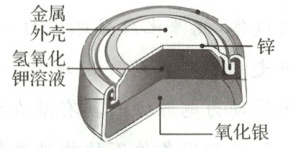
①氢氧化钾溶液中含有的阴离子为
②电池放电时,反应原理为${Zn + Ag_{2}O\xlongequal{}X + 2Ag}$。
ⅰ. ${Ag_{2}O}$中银元素的化合价为
ⅱ. $X$的化学式为
ⅲ. 放电时将化学能转化为
(1)典籍中的化学
《天工开物》被誉为“中国17世纪工艺百科全书”,其中描述了锡的冶炼方法,如图。

①炼锡时混入少许铅形成合金,产物更易熔化流出,原因是
b
(填字母)。a. 增强硬度
b. 降低熔点
c. 增强抗腐蚀性
②锡砂中的${SnO_{2}}$与木炭在高温下反应生成锡和二氧化碳,化学方程式为
SnO₂ + C$\overset{高温}{=}$Sn + CO₂↑
。(2)生活中的化学

①如图为某品牌烧烤架,图中属于合成材料的是
bc
(填字母,下同)。②将鸡翅用铝箔包好进行烤制,过程中体现了铝箔具有良好的
导热
性。③小明烤制了下列食物,其中富含维生素的是
c
。a. 鱼
b. 鸡翅
c. 韭菜
(3)科技中的化学
银-锌纽扣电池可做太空微型电源,如图是其构造示意图。

①氢氧化钾溶液中含有的阴离子为
氢氧根离子(或OH⁻)
。②电池放电时,反应原理为${Zn + Ag_{2}O\xlongequal{}X + 2Ag}$。
ⅰ. ${Ag_{2}O}$中银元素的化合价为
+1
。ⅱ. $X$的化学式为
ZnO
。ⅲ. 放电时将化学能转化为
电
能。
答案:
21.(除特殊标注外,每空1分,共10分)
(1)①b ②SnO₂ + C$\overset{高温}{=}$Sn + CO₂↑(2分)
(2)①bc ②导热 ③c
(3)①氢氧根离子(或OH⁻) ②+1 ZnO 电
解析:
(1)①合金的熔点低于各组分金属,故炼锡时混入少许铅形成合金,产物更易熔化流出的原因是降低熔点。
(3)②i.Ag₂O中,O元素的化合价为 - 2,则Ag元素的化合价为 + 1。ii.由质量守恒定律知,Zn + Ag₂O = X + 2Ag中,X的化学式为ZnO。iii.放电时,将化学能转化为电能。
(1)①b ②SnO₂ + C$\overset{高温}{=}$Sn + CO₂↑(2分)
(2)①bc ②导热 ③c
(3)①氢氧根离子(或OH⁻) ②+1 ZnO 电
解析:
(1)①合金的熔点低于各组分金属,故炼锡时混入少许铅形成合金,产物更易熔化流出的原因是降低熔点。
(3)②i.Ag₂O中,O元素的化合价为 - 2,则Ag元素的化合价为 + 1。ii.由质量守恒定律知,Zn + Ag₂O = X + 2Ag中,X的化学式为ZnO。iii.放电时,将化学能转化为电能。
22 (6分)阅读下列短文,回答相关问题。
氨(${NH_{3}}$)是一种重要的化学物质,可用于制造硝酸和氮肥。
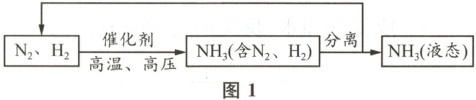
Ⅰ. 工业合成氨。流程示意图如图1所示。
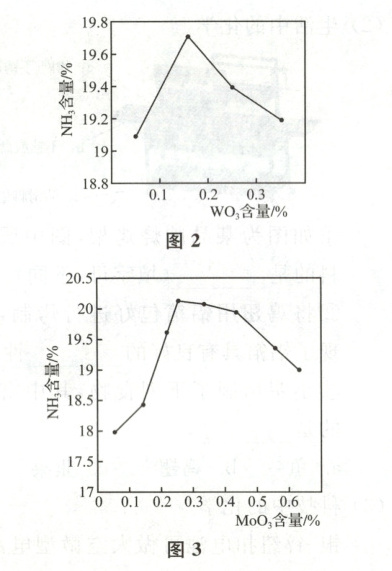
铁触媒催化剂用磁铁矿与三氧化钼(${MoO_{3}}$)、氧化钨(${WO_{3}}$)、氧化铝(${Al_{2}O_{3}}$)、混合稀土等原料,按不同比例充分混合得到,其中${WO_{3}}$、${MoO_{3}}$含量对产出气体中氨含量影响分别如图2、图3所示,氨含量越高代表催化剂活性越好。
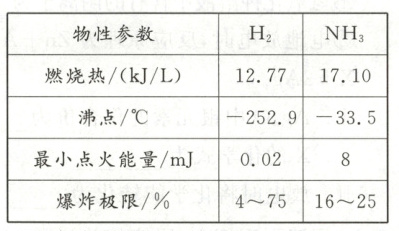
Ⅱ. 氨燃料。随着“双碳”目标的提出,氨作为氢的载体,能源化应用也成为研究热点,氨正由肥料走向燃料。研究发现氨作为燃料,在电动汽车等动力电源方面具有潜在的应用前景。其与氢气在相同条件下的物性参数对比见下表。
依据短文内容回答下列问题。
(1)合成氨的原料之一氮气主要来源于空气。空气中氮气的体积分数约为
(2)一定条件下,纯净的氨气在纯氧中燃烧生成氮气和水,反应的化学方程式为
(3)根据图2写出${WO_{3}}$含量与催化剂活性的关系是
(4)在压强$1.01× 10^{5}\ {Pa}$下,氮气的沸点为$-195.8\ {^{\circ}C}$(${NH_{3}}$与${H_{2}}$沸点见短文中表格),欲将${NH_{3}}$与${N_{2}}$、${H_{2}}$分离,将温度控制在
(5)下列说法不正确的是
a. 氨气比氢气更容易被点燃
b. 三氧化钼(${MoO_{3}}$)、氧化钨(${WO_{3}}$)、氧化铝(${Al_{2}O_{3}}$)都属于氧化物
c. 氢气液化储存比氨气更易实现,但爆炸风险较大
d. 氨气具有非常大的潜在应用前景
氨(${NH_{3}}$)是一种重要的化学物质,可用于制造硝酸和氮肥。
Ⅰ. 工业合成氨。流程示意图如图1所示。

铁触媒催化剂用磁铁矿与三氧化钼(${MoO_{3}}$)、氧化钨(${WO_{3}}$)、氧化铝(${Al_{2}O_{3}}$)、混合稀土等原料,按不同比例充分混合得到,其中${WO_{3}}$、${MoO_{3}}$含量对产出气体中氨含量影响分别如图2、图3所示,氨含量越高代表催化剂活性越好。

Ⅱ. 氨燃料。随着“双碳”目标的提出,氨作为氢的载体,能源化应用也成为研究热点,氨正由肥料走向燃料。研究发现氨作为燃料,在电动汽车等动力电源方面具有潜在的应用前景。其与氢气在相同条件下的物性参数对比见下表。

依据短文内容回答下列问题。
(1)合成氨的原料之一氮气主要来源于空气。空气中氮气的体积分数约为
78%
。(2)一定条件下,纯净的氨气在纯氧中燃烧生成氮气和水,反应的化学方程式为
4NH₃ + 3O₂$\overset{一定条件}{=}$2N₂ + 6H₂O
。(3)根据图2写出${WO_{3}}$含量与催化剂活性的关系是
随着WO₃含量升高,催化剂活性先变好后变差(合理即可)
。(4)在压强$1.01× 10^{5}\ {Pa}$下,氮气的沸点为$-195.8\ {^{\circ}C}$(${NH_{3}}$与${H_{2}}$沸点见短文中表格),欲将${NH_{3}}$与${N_{2}}$、${H_{2}}$分离,将温度控制在
-195.8~ - 33.5℃
范围内。(5)下列说法不正确的是
ac
(填字母)。a. 氨气比氢气更容易被点燃
b. 三氧化钼(${MoO_{3}}$)、氧化钨(${WO_{3}}$)、氧化铝(${Al_{2}O_{3}}$)都属于氧化物
c. 氢气液化储存比氨气更易实现,但爆炸风险较大
d. 氨气具有非常大的潜在应用前景
答案:
22.(除特殊标注外,每空1分,共6分)
(1)78%
(2)4NH₃ + 3O₂$\overset{一定条件}{=}$2N₂ + 6H₂O(2分)
(3)随着WO₃含量升高,催化剂活性先变好后变差(合理即可)
(4)-195.8~ - 33.5℃
(5)ac
解析:
(3)已知:氨含量越高代表催化剂活性越好。由图2知,随着WO₃含量升高,氨含量先增大后减小,即催化剂活性先变好后变差。
(4)1.01×10⁵Pa下,N₂的沸点为 - 195.8℃、NH₃沸点为 - 33.5℃、H₂的沸点为 - 252.9℃,欲将NH₃与N₂、H₂分离,将温度控制在 - 195.8~ - 33.5℃之间。
(5)H₂的最小点火能量比NH₃小,H₂比NH₃更容易被点燃,a错误;H₂的沸点比NH₃低,H₂液化储存比NH₃更难实现,c错误。
(1)78%
(2)4NH₃ + 3O₂$\overset{一定条件}{=}$2N₂ + 6H₂O(2分)
(3)随着WO₃含量升高,催化剂活性先变好后变差(合理即可)
(4)-195.8~ - 33.5℃
(5)ac
解析:
(3)已知:氨含量越高代表催化剂活性越好。由图2知,随着WO₃含量升高,氨含量先增大后减小,即催化剂活性先变好后变差。
(4)1.01×10⁵Pa下,N₂的沸点为 - 195.8℃、NH₃沸点为 - 33.5℃、H₂的沸点为 - 252.9℃,欲将NH₃与N₂、H₂分离,将温度控制在 - 195.8~ - 33.5℃之间。
(5)H₂的最小点火能量比NH₃小,H₂比NH₃更容易被点燃,a错误;H₂的沸点比NH₃低,H₂液化储存比NH₃更难实现,c错误。
查看更多完整答案,请扫码查看


