2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·河南信阳浉河区信阳二模)设 $ N_A $ 为阿伏加德罗常数的值,下列说法正确的是(
A.$ 0.1\ mol $ 环氧乙烷( )中所含 $ \sigma $ 键数为 $ 0.3N_A $
)中所含 $ \sigma $ 键数为 $ 0.3N_A $
B.标准状况下, $ 22.4\ L\ Cl_2 $ 完全溶于水,转移电子总数小于 $ N_A $
C.$ 0.1\ mol[Co(NH_3)_5Cl]Cl_2 $ 与足量硝酸银溶液反应,生成 $ AgCl $ 的数目为 $ 0.3N_A $
D.向 $ 1\ L\ 1\ mol·L^{-1} $ 乙醇水溶液中加入足量钠,生成 $ H_2 $ 分子的数目为 $ 0.5N_A $
B
)A.$ 0.1\ mol $ 环氧乙烷(
 )中所含 $ \sigma $ 键数为 $ 0.3N_A $
)中所含 $ \sigma $ 键数为 $ 0.3N_A $B.标准状况下, $ 22.4\ L\ Cl_2 $ 完全溶于水,转移电子总数小于 $ N_A $
C.$ 0.1\ mol[Co(NH_3)_5Cl]Cl_2 $ 与足量硝酸银溶液反应,生成 $ AgCl $ 的数目为 $ 0.3N_A $
D.向 $ 1\ L\ 1\ mol·L^{-1} $ 乙醇水溶液中加入足量钠,生成 $ H_2 $ 分子的数目为 $ 0.5N_A $
答案:
2.B 环氧乙烷中的C—O键、C—C键、C—H键均为σ键,0.1mol环氧乙烷中所含σ键数目为0.7Nₐ,A错误;标准状况下,22.4LCl₂的物质的量为1mol,氯气与水反应属于可逆反应,1mol氯气完全溶于水转移电子数小于Nₐ,B正确;[Co(NH₃)₅Cl]Cl₂中外界的Cl⁻能够电离出来,0.1mol[Co(NH₃)₅Cl]Cl₂中能够电离出0.2molCl⁻,与足量硝酸银溶液反应,生成AgCl的数目为0.2Nₐ,C错误;向1L1mol·L⁻¹乙醇水溶液中加入足量钠,1mol乙醇与钠反应生成0.5mol氢气,由于水也会与钠反应,因此生成的H₂分子数目大于0.5Nₐ,D错误;故选B。
2.B 环氧乙烷中的C—O键、C—C键、C—H键均为σ键,0.1mol环氧乙烷中所含σ键数目为0.7Nₐ,A错误;标准状况下,22.4LCl₂的物质的量为1mol,氯气与水反应属于可逆反应,1mol氯气完全溶于水转移电子数小于Nₐ,B正确;[Co(NH₃)₅Cl]Cl₂中外界的Cl⁻能够电离出来,0.1mol[Co(NH₃)₅Cl]Cl₂中能够电离出0.2molCl⁻,与足量硝酸银溶液反应,生成AgCl的数目为0.2Nₐ,C错误;向1L1mol·L⁻¹乙醇水溶液中加入足量钠,1mol乙醇与钠反应生成0.5mol氢气,由于水也会与钠反应,因此生成的H₂分子数目大于0.5Nₐ,D错误;故选B。

3. (2025·四川资阳安岳中学二模)已知 $ N_A $ 为阿伏加德罗常数,下列关于 $ N_A $ 说法正确的是(
A.标准状况下 $ 22.4\ L\ HF $ 含有分子的个数为 $ N_A $
B.$ 1\ mol $ 液态冰醋酸中含 $ s - p\ \sigma $ 键的数目为 $ 4N_A $
C.往 $ FeBr_2 $ 溶液中通入氯气,若有 $ 1\ mol\ Br_2 $ 生成时,转移电子的数目可能为 $ 4N_A $
D.常温下已知 $ K_{sp}(CaSO_4) = 9×10^{-6} $,则该温度下 $ CaSO_4 $ 饱和溶液中含有 $ 3×10^{-3}N_A $ 个 $ Ca^{2+} $
C
)A.标准状况下 $ 22.4\ L\ HF $ 含有分子的个数为 $ N_A $
B.$ 1\ mol $ 液态冰醋酸中含 $ s - p\ \sigma $ 键的数目为 $ 4N_A $
C.往 $ FeBr_2 $ 溶液中通入氯气,若有 $ 1\ mol\ Br_2 $ 生成时,转移电子的数目可能为 $ 4N_A $
D.常温下已知 $ K_{sp}(CaSO_4) = 9×10^{-6} $,则该温度下 $ CaSO_4 $ 饱和溶液中含有 $ 3×10^{-3}N_A $ 个 $ Ca^{2+} $
答案:
3.C 标准状况下HF为液态,22.4LHF物质的量不是1mol,A错误;CH₃COOH中C、O经过杂化后与H形成σ键,因此1mol的液态冰醋酸中含s—pσ键数目为0,B错误;若有1molBr₂生成时,氯气先氧化Fe²⁺,再氧化Br⁻,总共转移电子的数目不能确定,至少为3mol,C正确;没有给出溶液体积,不能具体计算Ca²⁺个数,D错误;本题选C。
4. (2025·武汉市二模) $ N_A $ 是阿伏加德罗常数的值,下列说法正确的是(
A.$ 0.5\ mol\ XeF_2 $ 中氙的价层电子对数为 $ 2.5N_A $
B.标准状况下, $ 11.2\ L\ SO_3 $ 中原子总数为 $ 2N_A $
C.$ 0.2\ L\ 1\ mol·L^{-1}NaF $ 中阴离子总数小于 $ 0.2N_A $
D.电解精炼铜时,阳极减重 $ 64\ g $ 时,外电路转移电子数一定为 $ 2N_A $
A
)A.$ 0.5\ mol\ XeF_2 $ 中氙的价层电子对数为 $ 2.5N_A $
B.标准状况下, $ 11.2\ L\ SO_3 $ 中原子总数为 $ 2N_A $
C.$ 0.2\ L\ 1\ mol·L^{-1}NaF $ 中阴离子总数小于 $ 0.2N_A $
D.电解精炼铜时,阳极减重 $ 64\ g $ 时,外电路转移电子数一定为 $ 2N_A $
答案:
4.A XeF₂中Xe的价层电子对数为2 + $\frac{8 - 2×1}{2}$ = 5,0.5molXeF₂中氙的价层电子对数为0.5×5×Nₐ = 2.5Nₐ,A正确;标准状况下SO₃不是气体,不能用气体的摩尔体积进行计算物质的量,B错误;0.2L1mol·L⁻¹NaF的物质的量为0.2L×1mol·L⁻¹ = 0.2mol,Na⁺的物质的量为0.2mol,水还要电离产生H⁺,所以阳离子的数目大于0.2Nₐ,根据电荷守恒可知,阴离子总数大于0.2Nₐ,C错误;阳极为粗铜,含有Fe、Zn等,64g不都是Cu单质,转移电子数无法判断,D错误;答案选A。

4.A XeF₂中Xe的价层电子对数为2 + $\frac{8 - 2×1}{2}$ = 5,0.5molXeF₂中氙的价层电子对数为0.5×5×Nₐ = 2.5Nₐ,A正确;标准状况下SO₃不是气体,不能用气体的摩尔体积进行计算物质的量,B错误;0.2L1mol·L⁻¹NaF的物质的量为0.2L×1mol·L⁻¹ = 0.2mol,Na⁺的物质的量为0.2mol,水还要电离产生H⁺,所以阳离子的数目大于0.2Nₐ,根据电荷守恒可知,阴离子总数大于0.2Nₐ,C错误;阳极为粗铜,含有Fe、Zn等,64g不都是Cu单质,转移电子数无法判断,D错误;答案选A。


5. (2025·河南部分高中二模) $ V $、 $ W $、 $ X $、 $ Y $、 $ Z $、 $ Q $ 有如图所示的转化关系,常温下, $ V $、 $ W $ 是气态单质, $ Z $ 是红棕色气体, $ Q $ 是常见液体。设 $ N_A $ 是阿伏加德罗常数的值。下列说法正确的是(
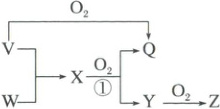
A.$ 1\ mol\ W $ 与足量 $ V $ 反应,可生成 $ X $ 的分子数目为 $ 2N_A $
B.反应①每生成 $ 1\ mol\ Y $,转移电子的数目为 $ 5N_A $
C.标准状况下, $ 22.4\ L\ Z $ 中含有原子的数目为 $ 3N_A $
D.$ 1\ mol\ Z $ 溶于 $ Q $ 中,可生成阴离子的数目为 $ N_A $
B
)
A.$ 1\ mol\ W $ 与足量 $ V $ 反应,可生成 $ X $ 的分子数目为 $ 2N_A $
B.反应①每生成 $ 1\ mol\ Y $,转移电子的数目为 $ 5N_A $
C.标准状况下, $ 22.4\ L\ Z $ 中含有原子的数目为 $ 3N_A $
D.$ 1\ mol\ Z $ 溶于 $ Q $ 中,可生成阴离子的数目为 $ N_A $
答案:
5.B 常温下,V、W是气态单质,Z是红棕色气体,Q是常见液体,Z是NO₂、Q是H₂O;V与氧气反应生成H₂O,V是H₂;根据元素守恒,W是N₂、X是NH₃、Y是NO。合成氨是可逆反应,1molN₂与足量H₂反应,不可能完全转化为2molNH₃,故A错误;反应①是4NH₃ + 5O₂$\stackrel{催化剂}{\underset{△}{=\!=\!=}}$4NO + 6H₂O,N元素化合价由 - 3升高为 + 2,每生成1molNO,转移电子的数目为5Nₐ,故B正确;标准状况下NO₂是液体,且存在一定量N₂O₄,22.4L中含有的原子的物质的量不是3mol,故C错误;NO₂溶于水时生成HNO₃和NO:3NO₂ + H₂O = 2H⁺ + 2NO₃⁻ + NO,1molNO₂生成硝酸根的物质的量为$\frac{2}{3}$mol,故D错误;选B。
1. (2025·山东卷)下列实验涉及反应的离子方程式书写正确的是(
A.用NaOH溶液吸收少量SO₂:SO₂ + OH⁻ = HSO₃⁻
B.用Na₂O₂和水制备少量O₂:Na₂O₂ + H₂O = 2Na⁺ + 2OH⁻ + O₂↑
C.用MnO₂和浓盐酸制备Cl₂:MnO₂ + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn²⁺ + Cl₂↑ + 2H₂O
D.用稀硝酸溶解少量Cu粉:3Cu + 8H⁺ + 8NO₃⁻ = 3Cu(NO₃)₂ + 2NO↑ + 4H₂O
C
)A.用NaOH溶液吸收少量SO₂:SO₂ + OH⁻ = HSO₃⁻
B.用Na₂O₂和水制备少量O₂:Na₂O₂ + H₂O = 2Na⁺ + 2OH⁻ + O₂↑
C.用MnO₂和浓盐酸制备Cl₂:MnO₂ + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn²⁺ + Cl₂↑ + 2H₂O
D.用稀硝酸溶解少量Cu粉:3Cu + 8H⁺ + 8NO₃⁻ = 3Cu(NO₃)₂ + 2NO↑ + 4H₂O
答案:
1.C 二氧化锰与浓盐酸共热反应生成MnCl₂、Cl₂和H₂O,离子方程式为$MnO₂ + 4H⁺ + 2Cl⁻\overset{\triangle}{=}Mn²⁺ + Cl₂↑ + 2H₂O,$C正确;少量SO₂与OH⁻反应生成SO₃²⁻,故A错误;B项中原子不守恒,过氧化钠与水反应的离子方程式应为2Na₂O₂ + 2H₂O = 4Na⁺ + 4OH⁻ + O₂↑,B错误;Cu(NO₃)₂为可溶性盐,离子方程式需拆开,铜与稀硝酸反应的离子方程式为3Cu + 8H⁺ + 2NO₃⁻ = 3Cu²⁺ + 2NO↑ + 4H₂O,D错误。
2. (2025·陕晋青宁卷)下列有关反应方程式错误的是(
A.泡沫灭火器反应原理:6NaHCO₃ + Al₂(SO₄)₃ = 3Na₂SO₄ + 2Al(OH)₃↓ + 6CO₂↑
B.用金属钠除去甲苯中的微量水:2Na + 2H₂O = 2NaOH + H₂↑
C.用NaOH溶液吸收尾气中的NO₂:2NO₂ + 2OH⁻ = NO₃⁻ + NO₂⁻ + H₂O
D.氯气通入冷的石灰乳中制漂白粉:Cl₂ + 2OH⁻ = ClO⁻ + Cl⁻ + H₂O
D
)A.泡沫灭火器反应原理:6NaHCO₃ + Al₂(SO₄)₃ = 3Na₂SO₄ + 2Al(OH)₃↓ + 6CO₂↑
B.用金属钠除去甲苯中的微量水:2Na + 2H₂O = 2NaOH + H₂↑
C.用NaOH溶液吸收尾气中的NO₂:2NO₂ + 2OH⁻ = NO₃⁻ + NO₂⁻ + H₂O
D.氯气通入冷的石灰乳中制漂白粉:Cl₂ + 2OH⁻ = ClO⁻ + Cl⁻ + H₂O
答案:
2.D 泡沫灭火器工作时NaHCO₃和Al₂(SO₄)₃发生相互促进的水解反应生成Al(OH)₃和CO₂,A正确;Na与H₂O反应生成NaOH和H₂,B正确;NO₂与NaOH反应生成NaNO₃和NaNO₂,C正确;石灰乳是悬浊液,Ca(OH)₂在离子方程式中不能拆写,正确的离子方程式为2Cl₂ + 2Ca(OH)₂ = 2Ca²⁺ + 2Cl⁻ + 2ClO⁻ + 2H₂O,D错误。
3. (2025·河南卷)对于下列过程中发生的化学反应,相应离子方程式正确的是(
A.磷酸二氢钠水解:H₂PO₄⁻ + H₂O $\rightleftharpoons$ H₃PO₄ + OH⁻
B.用稀盐酸浸泡氧化银:Ag₂O + 2H⁺ = 2Ag⁺ + H₂O
C.向次氯酸钠溶液中加入碘化氢溶液:ClO⁻ + H⁺ = HClO
D.向硫酸氢钠溶液中滴加少量碳酸氢钡溶液:H⁺ + SO₄²⁻ + Ba²⁺ + HCO₃⁻ = BaSO₄↓ + CO₂↑ + H₂O
A
)A.磷酸二氢钠水解:H₂PO₄⁻ + H₂O $\rightleftharpoons$ H₃PO₄ + OH⁻
B.用稀盐酸浸泡氧化银:Ag₂O + 2H⁺ = 2Ag⁺ + H₂O
C.向次氯酸钠溶液中加入碘化氢溶液:ClO⁻ + H⁺ = HClO
D.向硫酸氢钠溶液中滴加少量碳酸氢钡溶液:H⁺ + SO₄²⁻ + Ba²⁺ + HCO₃⁻ = BaSO₄↓ + CO₂↑ + H₂O
答案:
3.A 磷酸二氢钠水解生成磷酸和氢氧化钠,其水解反应的离子方程式为H₂PO₄⁻ + H₂O⇌H₃PO₄ + OH⁻,A正确;用稀盐酸浸泡氧化银生成氯化银沉淀和水,其反应的离子方程式为Ag₂O + 2H⁺ + 2Cl⁻ = 2AgCl + H₂O,B错误;次氯酸钠溶液具有强氧化性,因此向次氯酸钠溶液中加入碘化氢溶液会发生氧化还原反应生成I₂和Cl⁻,其离子方程式为ClO⁻ + 2H⁺ + 2I⁻ = I₂ + Cl⁻ + H₂O,C错误;向硫酸氢钠溶液中滴加少量碳酸氢钡溶液,其离子方程式为Ba²⁺ + 2HCO₃⁻ + 2H⁺ + SO₄²⁻ = BaSO₄↓ + 2CO₂↑ + 2H₂O,D错误。
查看更多完整答案,请扫码查看


