2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2025·福建厦门二模) 一种半导体材料 $ FeSb_2 $ 的晶胞结构如图。已知晶胞 $ \alpha = \beta = \gamma = 90° $,$ a \neq b \neq c $,设 $ N_A $ 为阿伏加德罗常数的值。下列有关说法错误的是(

A.$ Sb $ 位于晶胞的体内和面上
B.该晶体的密度为 $ \frac{6 × 10^{32}}{N_A × abc} g · cm^{-3} $
C.$ Sb $ 的配位数为 $ 4 $
D.$ 1 $ 号原子与 $ 2 $ 号原子核间距为 $ \frac{\sqrt{a^2 + b^2 + c^2}}{2} pm $
C
)
A.$ Sb $ 位于晶胞的体内和面上
B.该晶体的密度为 $ \frac{6 × 10^{32}}{N_A × abc} g · cm^{-3} $
C.$ Sb $ 的配位数为 $ 4 $
D.$ 1 $ 号原子与 $ 2 $ 号原子核间距为 $ \frac{\sqrt{a^2 + b^2 + c^2}}{2} pm $
答案:
3.C 由图,1、2号铁位于顶点和体内,据“均摊法”,晶胞中含$8 × \frac{1}{8}+1=2$个Fe,结合化学式$\mathrm{FeSb_2}$,则2个Sb位于体内、4个位于面上,含$4 × \frac{1}{2}+2=4$个Sb,A正确;结合A分析,该晶体的密度为$\frac{2M}{abc} × \frac{10^{30}}{N_{\mathrm{A}}} \ \mathrm{g · cm^{-3}}=\frac{6 × 10^{32}}{N_{\mathrm{A}} × abc} \ \mathrm{g · cm^{-3}}$,B正确;由图可知铁的配位数6,根据化学式可知Sb的配位数为3,C错误;1号原子与2号原子核间距为体对角线的二分之一:$\frac{\sqrt{a^2+b^2+c^2}}{2} \mathrm{pm}$,D正确;故选C。
4. (2025·四川绵阳普明中学二模) 黑辰砂($ \beta-HgS $)大多数是黑色结晶状,其晶胞结构如图所示。已知阿伏加德罗常数的值为 $ N_A $,晶体密度为 $ \rho g · cm^{-3} $。下列说法正确的是(

A.$ Hg $ 位于元素周期表中 $ p $ 区
B.$ Hg^{2+} $ 位于 $ S^{2-} $ 构成的正四面体中心
C.该晶胞中最近的 $ S^{2-} $ 之间的距离为 $ \sqrt[3]{\frac{932}{\rho N_A}} cm $
D.若 $ c $ 的原子分数坐标为 $ (1,1,1) $,则 $ b $ 的原子分数坐标为 $ (\frac{3}{4}, \frac{1}{4}, \frac{1}{4}) $
B
)
A.$ Hg $ 位于元素周期表中 $ p $ 区
B.$ Hg^{2+} $ 位于 $ S^{2-} $ 构成的正四面体中心
C.该晶胞中最近的 $ S^{2-} $ 之间的距离为 $ \sqrt[3]{\frac{932}{\rho N_A}} cm $
D.若 $ c $ 的原子分数坐标为 $ (1,1,1) $,则 $ b $ 的原子分数坐标为 $ (\frac{3}{4}, \frac{1}{4}, \frac{1}{4}) $
答案:
4.B $\mathrm{Hg}$在元素周期表中位于第六周期第ⅡB族,属于ds区,A错误;由图可知,$\mathrm{Hg^{2+}}$位于$\mathrm{S^{2-}}$构成的正四面体中心,B正确;在1个$\mathrm{HgS}$晶胞中,含有4个$\mathrm{Hg^{2+}}$和$8 × \frac{1}{8}+6 × \frac{1}{2}=4$个$\mathrm{S^{2-}}$,则该晶胞的边长=$\sqrt[3]{\frac{932}{\rho N_{\mathrm{A}}}} \mathrm{cm}$,而在该晶胞中$\mathrm{S^{2-}}$之间的最短距离是顶点到面心的距离,故距离为$\frac{\sqrt{2}}{2} \sqrt[3]{\frac{932}{\rho N_{\mathrm{A}}}} \mathrm{cm}$,C错误;若c的原子分数坐标为$(1,1,1)$,说明a为坐标原点,则b的原子分数坐标为$(\frac{3}{4},\frac{3}{4},\frac{1}{4})$,D错误;故选B。
5. (2025·河南名校学术联盟二模) $ Cu_2O $ 的立方晶胞如图,晶胞参数为 $ a pm $,$ m $ 点的分数坐标为 $ (\frac{3}{4}, \frac{1}{4}, \frac{1}{4}) $,设阿伏加德罗常数的值为 $ N_A $,下列说法错误的是(

A.$ O $ 的配位数为 $ 4 $
B.$ Cu $ 与 $ O $ 的最近距离为 $ \frac{\sqrt{3}}{4}a pm $
C.$ n $ 点的分数坐标为 $ (\frac{1}{4}, \frac{1}{4}, \frac{3}{4}) $
D.晶体密度 $ \rho = \frac{2 × (128 + 16) × 10^{21}}{a^3 × N_A} g · cm^{-3} $
D
)
A.$ O $ 的配位数为 $ 4 $
B.$ Cu $ 与 $ O $ 的最近距离为 $ \frac{\sqrt{3}}{4}a pm $
C.$ n $ 点的分数坐标为 $ (\frac{1}{4}, \frac{1}{4}, \frac{3}{4}) $
D.晶体密度 $ \rho = \frac{2 × (128 + 16) × 10^{21}}{a^3 × N_A} g · cm^{-3} $
答案:
5.D 由图知,晶胞体心O原子距离最近的Cu原子数有4个,O的配位数为4,A正确;Cu与O的最近距离为体对角线的$\frac{1}{4}$,即$\frac{\sqrt{3}}{4}a \ \mathrm{pm}$,B正确;由m点的分数坐标为$(\frac{3}{4},\frac{1}{4},\frac{1}{4})$可知,n点在xyz轴投影坐标分别为$\frac{1}{4}$、$\frac{1}{4}$、$\frac{3}{4}$,分数坐标为$(\frac{1}{4},\frac{1}{4},\frac{3}{4})$,C正确;据“均摊法”,晶胞中含$8 × \frac{1}{8}+1=2$个O、4个Cu,则晶体密度为$\frac{2M}{a^3} × \frac{10^{30}}{N_{\mathrm{A}}} \ \mathrm{g · cm^{-3}}=\frac{2 × (128+16) × 10^{30}}{a^3 × N_{\mathrm{A}}} \ \mathrm{g · cm^{-3}}$,D错误;故选D。
1. (2025·湖北卷)N 和 P 为同主族相邻元素。下列关于物质性质或现象的解释错误的是(
A.KNO₃的熔点比 K₃PO₄的低,因为 KNO₃的离子键更强
B.磷单质通常不以 P₂形式存在,因为磷磷之间难以形成三键
C.次磷酸 比硝酸
比硝酸  的酸性弱,因为前者的 H—O 键极性小
的酸性弱,因为前者的 H—O 键极性小
D.P 形成 PF₅而 N 形成 NF₃,因为 P 的价层电子轨道更多且半径更大
A
)A.KNO₃的熔点比 K₃PO₄的低,因为 KNO₃的离子键更强
B.磷单质通常不以 P₂形式存在,因为磷磷之间难以形成三键
C.次磷酸
 比硝酸
比硝酸  的酸性弱,因为前者的 H—O 键极性小
的酸性弱,因为前者的 H—O 键极性小D.P 形成 PF₅而 N 形成 NF₃,因为 P 的价层电子轨道更多且半径更大
答案:
1.A 离子晶体熔点的差异源于离子键的强度。$K_{3}PO_{4}$中$PO_{4}^{3-}$带$3$个负电荷,而$KNO_{3}$中$NO_{3}^{-}$只带$1$个负电荷;离子所带电荷越高,静电引力越强,离子键越强,熔点越高。因此,$K_{3}PO_{4}$的离子键比$KNO_{3}$更强,A错误;氮因原子半径小,p轨道有效重叠,能形成稳定的$N\equivN$三键;磷原子半径大,p轨道重叠差,难以形成稳定的$P\equivP$三键,因此倾向于形成$P_{4}$四面体结构,B正确;含氧酸的酸性与$O—H$键极性有关。中心原子电负性越高,$O—H$极性越大,越易解离$H^{+}$;氮电负性高于磷,因此$HNO_{3}$中$O—H$键极性大,酸性强;$H_{3}PO_{2}$中$P$电负性低,$O—H$键极性小,酸性弱,C正确;氮价层仅有$2s$和$2p$轨道,$NF_{3}$的中心原子$N$形成$sp^{3}$杂化后有$3$个$\sigma$键和$1$个孤对电子;磷有$3d$轨道可参与$sp^{3}d$杂化,且原子半径大,能容纳$5$个配体,故形成$PF_{5}$,D正确;故选A。
2. (2025·安徽卷)碘晶体为层状结构,层间作用为范德华力,层间距为 d pm。如图给出了碘的单层结构,层内碘分子间存在“卤键”(强度与氢键相近)。Nₐ为阿伏加德罗常数的值。下列说法错误的是(
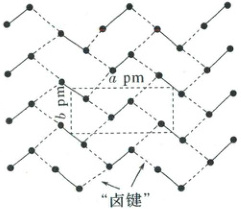
A.碘晶体是混合型晶体
B.液态碘单质中也存在“卤键”
C.127 g 碘晶体中有 Nₐ个“卤键”
D.碘晶体的密度为$\frac{2×254}{abd×N_A×10^{-30}}$ g·cm⁻³
A
)
A.碘晶体是混合型晶体
B.液态碘单质中也存在“卤键”
C.127 g 碘晶体中有 Nₐ个“卤键”
D.碘晶体的密度为$\frac{2×254}{abd×N_A×10^{-30}}$ g·cm⁻³
答案:
2.A 碘晶体为分子晶体,A错误;“卤键”是分子间作用力,液态碘分子间距离较近,也存在“卤键”,故B正确;$127 g$碘晶体的物质的量为$0.5 mol$,根据题图可知,$1$个$I_{2}$形成$4$个“卤键”,$1$个“卤键”被$2$个$I_{2}$共有,故$127 g$碘晶体中含有“卤键”的数目为$0.5 mol×4×\frac{1}{2}N_{A} mol^{-1}=N_{A}$,C正确;题图方框条件下形成的重复单元的体积为$a× b× d×10^{-30} cm^{3}$,且上、下层中各含$2$个$I_{2}$,故碘晶体的密度为$\frac{2×254}{a× b× d× N_{A}×10^{-30}} g·cm^{-3}$,D正确。
查看更多完整答案,请扫码查看


