2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
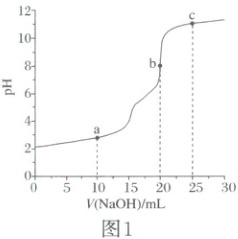
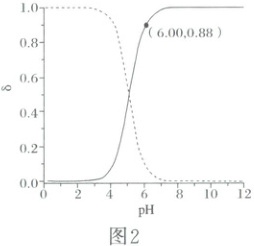
1. (2025·云南卷)甲醛法测定${NH^{+}_{4}}$的反应原理为${4NH^{+}_{4} + 6HCHO\xlongequal{}(CH_{2})_{6}N_{4}H^{+} + 3H^{+} + 6H_{2}O}$。取含${NH_{4}Cl}$的废水浓缩至原体积的$\dfrac{1}{10}$后,移取$20.00\ mL$,加入足量甲醛反应后,用$0.01000\ mol·L^{-1}$的${NaOH}$标准溶液滴定。滴定曲线如图1,含氮微粒的分布分数$\delta$与$pH$关系如图2[比如:$\delta [(CH_{2})_{6}N_{4}H^{+}]=\dfrac{c[(CH_{2})_{6}N_{4}H^{+}]}{c[(CH_{2})_{6}N_{4}H^{+}] + c[(CH_{2})_{6}N_{4}]}$]。下列说法正确的是(
A.废水中${NH^{+}_{4}}$的含量为$20.00\ mg·L^{-1}$
B.c点:$c[(CH_{2})_{6}N_{4}H^{+}] + c(H^{+}) = c(OH^{-})$
C.a点:$c[(CH_{2})_{6}N_{4}H^{+}] > c(H^{+}) > c(OH^{-}) > c[(CH_{2})_{6}N_{4}]$
D.$(CH_{2})_{6}N_{4}H^{+}⇌ (CH_{2})_{6}N_{4} + H^{+}$的平衡常数$K\approx7.3×10^{-6}$
D
)
A.废水中${NH^{+}_{4}}$的含量为$20.00\ mg·L^{-1}$
B.c点:$c[(CH_{2})_{6}N_{4}H^{+}] + c(H^{+}) = c(OH^{-})$
C.a点:$c[(CH_{2})_{6}N_{4}H^{+}] > c(H^{+}) > c(OH^{-}) > c[(CH_{2})_{6}N_{4}]$
D.$(CH_{2})_{6}N_{4}H^{+}⇌ (CH_{2})_{6}N_{4} + H^{+}$的平衡常数$K\approx7.3×10^{-6}$

答案:
1.D 由图1中的信息可知,当加入NaOH标准溶液的体积为20.00mL时到达滴定终点,由关系式$4NH_4^+\sim[(CH_2)_6N_4H^++3H^+]\sim4OH^-$可知,由于待测液的体积和标准溶液的体积相同,因此,浓缩后的20.00mL溶液中$c(NH_4^+)=c(OH^-)=0.01000mol· L^{-1}$,则原废水中$c(NH_4^+)=0.01000mol· L^{-1}×\frac{1}{10}=0.001000mol· L^{-1}$,因此,废水中$NH_4^+$的含量为$0.001000mol×18000mg· mol^{-1}· L^{-1}=18mg· L^{-1}$,A错误;c点加入NaOH标准溶液的体积过量,且只过量了$\frac{1}{5}$,由电荷守恒可知,$c[(CH_2)_6N_4H^+]+c(H^+)+c(Na^+)=c(OH^-)+c(Cl^-)$,浓缩后的废水中$NH_4Cl$的浓度是NaOH标准溶液浓度的4倍,$Cl^-$和$Na^+$均不参与离子反应,可以估算$c(Cl^-)>c(Na^+)$,$c[(CH_2)_6N_4H^+]+c(H^+)>c(OH^-)$,B错误;$(CH_2)_6N_4H^+$在溶液中水解使溶液显酸性,类比$NH_3$可知$(CH_2)_6N_4$在溶液中与水作用发生电离而使溶液显碱性;a点为半滴定点,由其纵坐标可知溶液显酸性,说明$(CH_2)_6N_4H^+$的水解作用强于$(CH_2)_6N_4$的电离作用,可知溶液中相关粒子的浓度的大小关系为$c[(CH_2)_6N_4]>c[(CH_2)_6N_4H^+]$,C错误;由图1和图2可知,当$pH=6.00$时,$(CH_2)_6N_4$占比较高,$\delta[(CH_2)_6N_4]=0.88$,则由氮元素守恒可知,$\delta[(CH_2)_6N_4H^+]=0.12$,两种粒子的浓度之比等于其分布分数之比,则$(CH_2)_6N_4H^+\rightleftharpoons (CH_2)_6N_4+H^+$的平衡常数$K=\frac{c[(CH_2)_6N_4]· c(H^+)}{c[(CH_2)_6N_4H^+]}=\frac{0.88×10^{-6}}{0.12}\approx7.3×10^{-6}$,D正确;综上所述,本题选D。
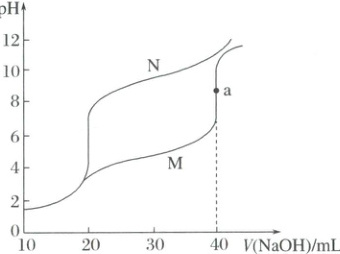
2. (2024·广西卷)常温下,用$0.1000\ mol·L^{-1}\ {NaOH}$溶液分别滴定下列两种混合溶液:
Ⅰ.$20.00\ mL$浓度均为$0.1000\ mol·L^{-1}\ {HCl}$和${CH_{3}COOH}$溶液
Ⅱ.$20.00\ mL$浓度均为$0.1000\ mol·L^{-1}\ {HCl}$和${NH_{4}Cl}$溶液
两种混合溶液的滴定曲线如图。
已知$K_{a}({CH_{3}COOH}) = K_{b}({NH_{3}· H_{2}O}) = 1.8×10^{-5}$,下列说法正确的是(
A.Ⅰ对应的滴定曲线为N线
B.a点水电离出的$c(OH^{-})$数量级为$10^{-8}$
C.$V({NaOH}) = 30.00\ mL$时,Ⅱ中$c(Cl^{-}) > c({NH_{3}· H_{2}O}) > c({NH^{+}_{4}})$
D.$pH = 7$时,Ⅰ中$c({CH_{3}COO^{-}})$、$c({CH_{3}COOH})$之和小于Ⅱ中$c({NH_{3}· H_{2}O})$、$c({NH^{+}_{4}})$之和
Ⅰ.$20.00\ mL$浓度均为$0.1000\ mol·L^{-1}\ {HCl}$和${CH_{3}COOH}$溶液
Ⅱ.$20.00\ mL$浓度均为$0.1000\ mol·L^{-1}\ {HCl}$和${NH_{4}Cl}$溶液
两种混合溶液的滴定曲线如图。
已知$K_{a}({CH_{3}COOH}) = K_{b}({NH_{3}· H_{2}O}) = 1.8×10^{-5}$,下列说法正确的是(
D
)
A.Ⅰ对应的滴定曲线为N线
B.a点水电离出的$c(OH^{-})$数量级为$10^{-8}$
C.$V({NaOH}) = 30.00\ mL$时,Ⅱ中$c(Cl^{-}) > c({NH_{3}· H_{2}O}) > c({NH^{+}_{4}})$
D.$pH = 7$时,Ⅰ中$c({CH_{3}COO^{-}})$、$c({CH_{3}COOH})$之和小于Ⅱ中$c({NH_{3}· H_{2}O})$、$c({NH^{+}_{4}})$之和
答案:
2.D 溶液中加入40mL氢氧化钠溶液时,Ⅰ中的溶质为氯化钠和醋酸钠,Ⅱ中的溶质为氯化钠和一水合氨,根据$K_a(CH_3COOH)=K_b(NH_3· H_2O)=1.8×10^{-5},$醋酸根离子、铵根离子的水解程度小于醋酸、一水合氨的电离程度,氯化钠显中性,醋酸根离子和一水合氨在浓度相同时,一水合氨溶液的碱性更强,故Ⅰ对应的滴定曲线为M,Ⅱ对应的滴定曲线为N。A项,向溶液中加入40mL氢氧化钠溶液时,Ⅰ中的溶质为氯化钠和醋酸钠,Ⅱ中的溶质为氯化钠和一水合氨,氯化钠显中性,醋酸根离子和一水合氨在浓度相同时,一水合氨溶液的碱性更强,故Ⅰ对应的滴定曲线为M,A错误;B项,a点的溶质为氯化钠和醋酸钠,醋酸根离子发生水解,溶液的pH接近8,由水电离的c(H^+)=c(OH^-),数量级接近$10^{-6},$B错误;C项,当V(NaOH)=30.00mL时,Ⅱ中的溶质为氯化钠、氯化铵、一水合氨,且氯化铵和一水合氨的浓度相同,铵根离子的水解$K_h=\frac{K_w}{K_a}=\frac{10^{-14}}{1.8×10^{-5}}=5.6×10^{-10}$<1.8×10^{-5},即NH_4^+水解程度小于一水合氨的电离程度,所以c(NH_4^+)>$c(NH_3· H_2O),$又元素质量守恒$c(Cl^-)=2c(NH_4^+)+2c(NH_3· H_2O),$即$c(Cl^-)>c(NH_4^+)>c(NH_3· H_2O),$C错误;D项,根据元素质量守恒,$n(CH_3COO^-)、$$n(CH_3COOH)$之和等于$n(NH_3· H_2O)、$$n(NH_4^+)$之和,根据图像,pH=7时,Ⅱ所加氢氧化钠溶液较少,溶液体积较小,故Ⅰ中$c(CH_3COO^-)、$$c(CH_3COOH)$之和小于Ⅱ中$c(NH_3· H_2O)、$$c(NH_4^+)$之和,D正确;故选D。
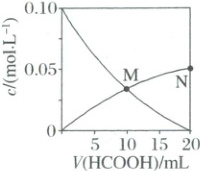
3. (2024·湖南卷)常温下$K_{a}({HCOOH}) = 1.8×10^{-4}$,向$20\ mL\ 0.1\ mol·L^{-1}\ {NaOH}$溶液中缓慢滴入相同浓度的${HCOOH}$溶液,混合溶液中某两种离子的浓度随加入${HCOOH}$溶液体积的变化关系如图所示,下列说法错误的是(
A.水的电离程度:$M < N$
B.M点:$2c(OH^{-}) = c(Na^{+}) + c(H^{+})$
C.当$V({HCOOH}) = 10\ mL$时,$c(OH^{-}) = c(H^{+}) + 2c({HCOOH}) + c({HCOO^{-}})$
D.N点:$c(Na^{+}) > c({HCOO^{-}}) > c(OH^{-}) > c(H^{+}) > c({HCOOH})$
D
)
A.水的电离程度:$M < N$
B.M点:$2c(OH^{-}) = c(Na^{+}) + c(H^{+})$
C.当$V({HCOOH}) = 10\ mL$时,$c(OH^{-}) = c(H^{+}) + 2c({HCOOH}) + c({HCOO^{-}})$
D.N点:$c(Na^{+}) > c({HCOO^{-}}) > c(OH^{-}) > c(H^{+}) > c({HCOOH})$
答案:
3.D 结合起点和终点,向$20mL0.10mol· L^{-1}NaOH$溶液中滴入相同浓度的HCOOH溶液,发生浓度改变的微粒是$Na^+$、$OH^-$、$H^+$和$HCOO^-$;当$V(HCOOH)=0mL$时,溶液中存在$Na^+$、$H^+$和$OH^-$,$c(OH^-)=c(Na^+)=0.10mol· L^{-1}$,随着加入HCOOH溶液,$c(Na^+)$减少但不会降到0,当$V(HCOOH)=20mL$时,$c(Na^+)=0.05mol· L^{-1}$,随着加入HCOOH溶液,$c(OH^-)$会与HCOOH反应而减少,溶质由NaOH变为NaOH和HCOONa混合物,最终为HCOONa,$c(H^+)$增加得很少,而$c(HCOO^-)$增加得多,当$V(HCOOH)=20mL$时,溶质为HCOONa,$HCOO^-$少部分水解,$c(HCOO^-)<0.05mol· L^{-1}$,斜率为正的曲线代表$c(HCOO^-)$,即经过M点在下降的曲线表示的是$OH^-$浓度的改变,经过M点、N点的在上升的曲线表示的是$HCOO^-$浓度的改变。N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,此时仅存在HCOONa的水解,M点时仍剩余有未反应的NaOH,对水的电离产生抑制,故水的电离程度:M<N,A正确;M点溶液中电荷守恒有$c(Na^+)+c(H^+)=c(HCOO^-)+c(OH^-)$,M点$c(HCOO^-)=c(OH^-)$,联立可得$2c(OH^-)=c(Na^+)+c(H^+)$,B正确;当$V(HCOOH)=10mL$时,溶液中的溶质为$c(NaOH):c(HCOONa)=1:1$,根据电荷守恒有$c(Na^+)+c(H^+)=c(HCOO^-)+c(OH^-)$,根据元素守恒$c(Na^+)=2c(HCOO^-)+2c(HCOOH)$,两式整理可得$c(OH^-)=c(H^+)+2c(HCOOH)+c(HCOO^-)$,C正确;N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,HCOO^-发生水解,因此$c(Na^+)>c(HCOO^-)$及$c(OH^-)>c(H^+)$,观察图中N点可知,$c(HCOO^-)\approx0.05mol· L^{-1}$,根据$K_a(HCOOH)=\frac{c(H^+)· c(HCOO^-)}{c(HCOOH)} =1.8×10^{-4}$,可知$c(HCOOH)>c(H^+)$,D错误。
查看更多完整答案,请扫码查看


