2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·山东菏泽二模)近期研究人员证实了含碳—碳单电子$\sigma$键化合物的存在。其中一种化合物的结构如图,虚线和圆点表示仅有 1 个共用电子的共价键。下列说法错误的是(

A.该化合物含有离子键、共价键
B.该化合物中碳原子的杂化方式为$sp^{2}$
C.该碳—碳单电子$\sigma$键的键长比普通碳—碳单键的键长要长
D.依据价层电子对互斥理论,$I_{3}^{-}$的中心碘原子价层电子对数为 5
B
)
A.该化合物含有离子键、共价键
B.该化合物中碳原子的杂化方式为$sp^{2}$
C.该碳—碳单电子$\sigma$键的键长比普通碳—碳单键的键长要长
D.依据价层电子对互斥理论,$I_{3}^{-}$的中心碘原子价层电子对数为 5
答案:
2.B 该化合物由阴阳离子构成,含有离子键,阴阳离子内部含共价键,A正确;该化合物中苯环和碳碳双键连接的C原子为$sp^{2}$杂化,虚线和圆点连接的碳原子的杂化方式为$sp^{3}$杂化,B错误;该碳—碳单电子$\sigma$键仅有一个单电子,作用力较弱,键长比普通碳—碳单键的键长要长,C正确;依据价层电子对互斥理论,$I^{-}_{3}$的中心碘原子的价电子数为7,每个配位碘原子贡献1个电子,共2个(两个配位原子),由于离子带一个单位负电荷,需加上1个电子,价层电子对数为$\frac{7 + 2×1 + 1}{2}=5$,D正确;故选B。
3. (2025·萍乡二模)氧化二氯$(Cl_{2}O)$是净化饮用水的一种有效的净水剂,制备反应为$2Cl_{2}+2Na_{2}CO_{3}+H_{2}O = 2NaHCO_{3}+2NaCl+Cl_{2}O$,下列说法错误的是(
A.$Cl_{2}O$的结构式为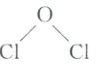
B.键角:$Cl_{2}O<H_{2}O<H_{2}S$
C.$CO_{3}^{2-}$中心原子的杂化方式为$sp^{2}$
D.$Cl_{2}$的电子云轮廓图为
B
)A.$Cl_{2}O$的结构式为

B.键角:$Cl_{2}O<H_{2}O<H_{2}S$
C.$CO_{3}^{2-}$中心原子的杂化方式为$sp^{2}$
D.$Cl_{2}$的电子云轮廓图为

答案:
3.B $Cl_{2}O$分子中,中心O原子的价层电子对数为4,采取$sp^{3}$杂化,其还有2个孤电子对,则结构式为 (2.png),A正确;$Cl_{2}O$、$H_{2}O$、$H_{2}S$中,中心原子的价层电子对数都为4,都采取$sp^{3}$杂化,但Cl原子电负性比H大,S原子电负性比O小,则共用电子对最靠近$H_{2}O$中的O原子,成键电子对间的排斥作用最大,键角最大,所以键角:$H_{2}S<H_{2}O$、$Cl_{2}O<H_{2}O$,B错误;$CO^{2-}_{3}$中心C原子的价层电子对数为$3+\frac{1}{2}(4 + 2 - 3×2)=3$,杂化方式为$sp^{2}$,C正确;形成$Cl_{2}$时,两个Cl原子发生3p电子云的重叠,p电子云呈哑铃形,则电子云轮廓图为
(2.png),A正确;$Cl_{2}O$、$H_{2}O$、$H_{2}S$中,中心原子的价层电子对数都为4,都采取$sp^{3}$杂化,但Cl原子电负性比H大,S原子电负性比O小,则共用电子对最靠近$H_{2}O$中的O原子,成键电子对间的排斥作用最大,键角最大,所以键角:$H_{2}S<H_{2}O$、$Cl_{2}O<H_{2}O$,B错误;$CO^{2-}_{3}$中心C原子的价层电子对数为$3+\frac{1}{2}(4 + 2 - 3×2)=3$,杂化方式为$sp^{2}$,C正确;形成$Cl_{2}$时,两个Cl原子发生3p电子云的重叠,p电子云呈哑铃形,则电子云轮廓图为 ,D正确。
,D正确。
3.B $Cl_{2}O$分子中,中心O原子的价层电子对数为4,采取$sp^{3}$杂化,其还有2个孤电子对,则结构式为
 (2.png),A正确;$Cl_{2}O$、$H_{2}O$、$H_{2}S$中,中心原子的价层电子对数都为4,都采取$sp^{3}$杂化,但Cl原子电负性比H大,S原子电负性比O小,则共用电子对最靠近$H_{2}O$中的O原子,成键电子对间的排斥作用最大,键角最大,所以键角:$H_{2}S<H_{2}O$、$Cl_{2}O<H_{2}O$,B错误;$CO^{2-}_{3}$中心C原子的价层电子对数为$3+\frac{1}{2}(4 + 2 - 3×2)=3$,杂化方式为$sp^{2}$,C正确;形成$Cl_{2}$时,两个Cl原子发生3p电子云的重叠,p电子云呈哑铃形,则电子云轮廓图为
(2.png),A正确;$Cl_{2}O$、$H_{2}O$、$H_{2}S$中,中心原子的价层电子对数都为4,都采取$sp^{3}$杂化,但Cl原子电负性比H大,S原子电负性比O小,则共用电子对最靠近$H_{2}O$中的O原子,成键电子对间的排斥作用最大,键角最大,所以键角:$H_{2}S<H_{2}O$、$Cl_{2}O<H_{2}O$,B错误;$CO^{2-}_{3}$中心C原子的价层电子对数为$3+\frac{1}{2}(4 + 2 - 3×2)=3$,杂化方式为$sp^{2}$,C正确;形成$Cl_{2}$时,两个Cl原子发生3p电子云的重叠,p电子云呈哑铃形,则电子云轮廓图为 ,D正确。
,D正确。 1. (2025·甘肃卷)物质的结构决定性质,下列事实与结构因素无关的是(
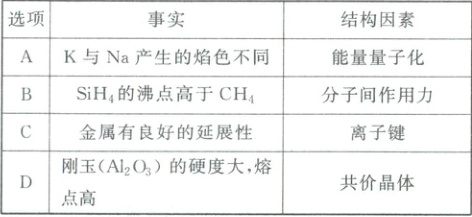
C
)
答案:
1.C K和Na产生的焰色不同,是因为能量是量子化的,二者核外电子从高能级跃迁回低能级释放的能量不同,A正确;$SiH_{4}$和$CH_{4}$均为分子晶体,$SiH_{4}$的相对分子质量更大,分子间作用力更强,故$SiH_{4}$的沸点高于$CH_{4}$,B正确;当金属受到外力作用时,晶体中的原子层间会发生相对滑动,但不会改变原来的排列方式,没有化学键的断裂与形成,所以金属有良好的延展性与离子键无关,C错误;$Al_{2}O_{3}$为共价晶体,故其硬度大、熔点高,D正确。
2. (2025·湖北卷)下列关于物质性质或应用解释错误的是(
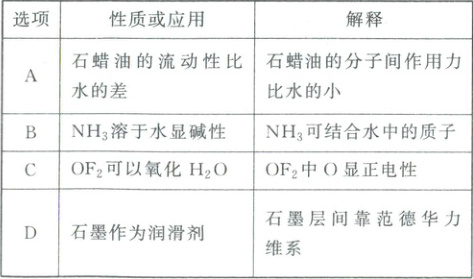
A
)
答案:
2.A 石蜡油的成分主要是高碳烷烃,相对分子质量大,分子间作用力大,导致粘度大,因此石蜡油流动性比水小的原因是分子间作用力比水分子间作用力大,A错误;$NH_{3}$中N有一对孤电子对,能与水提供的$H^{+}$结合,从而释放$OH^{-}$,因此$NH_{3}$溶于水显碱性,B正确;F的电负性大于O,$OF_{2}$中F显负电性,O显正电性,$H_{2}O$中O显负电性,$H_{2}O$中O容易转移电子给$OF_{2}$中O,因$OF_{2}$可以氧化$H_{2}O$,C正确;石墨是层状结构,石墨层间靠范德华力维系,范德华力较弱,导致层与层之间容易滑动,故石墨具有润滑性,D正确;答案选A。
3. (2025·山东卷)物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是(

A
)
答案:
3.A $H_{2}O$可形成分子间氢键,故沸点$H_{2}O>H_{2}S$,A错误;元素电负性:$Cl>Br$,故$HClO$中$O—H$极性大,更易断裂,故酸性:$HClO>HBrO$,B正确;原子半径:$Si>C$,则键长:$Si—Si$键$>C—C$键,键能:$Si—Si$键$<C—C$键,根据共价晶体中键能越大,形成的晶体硬度越大可知,硬度:金刚石$>$晶体硅,C正确;离子晶体的熔点大小与离子键强弱有关,离子所带电荷数越多、离子半径越小,离子键越强,物质熔点越高,离子电荷:$Mg^{2+}>Na^{+}$、$O^{2-}>F^{-}$,故熔点:$MgO>NaF$ ,D正确。
,D正确。
3.A $H_{2}O$可形成分子间氢键,故沸点$H_{2}O>H_{2}S$,A错误;元素电负性:$Cl>Br$,故$HClO$中$O—H$极性大,更易断裂,故酸性:$HClO>HBrO$,B正确;原子半径:$Si>C$,则键长:$Si—Si$键$>C—C$键,键能:$Si—Si$键$<C—C$键,根据共价晶体中键能越大,形成的晶体硬度越大可知,硬度:金刚石$>$晶体硅,C正确;离子晶体的熔点大小与离子键强弱有关,离子所带电荷数越多、离子半径越小,离子键越强,物质熔点越高,离子电荷:$Mg^{2+}>Na^{+}$、$O^{2-}>F^{-}$,故熔点:$MgO>NaF$
 ,D正确。
,D正确。 查看更多完整答案,请扫码查看


