2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2025·山东卷)常温下,假设 $ 1 \, L $ 水溶液中 $ Co^{2+} $ 和 $ C_2O_4^{2-} $ 初始物质的量浓度均为 $ 0.01 \, mol · L^{-1} $。平衡条件下,体系中全部四种含碳物种的摩尔分数随 $ pH $ 的变化关系如图所示(忽略溶液体积变化)。已知:体系中含钴物种的存在形式为 $ Co^{2+} $、$ CoC_2O_4(s) $ 和 $ Co(OH)_2(s) $;$ K_{sp}(CoC_2O_4) = 6.0 × 10^{-8} $,$ K_{sp}[Co(OH)_2] = 5.9 × 10^{-15} $。下列说法正确的是(
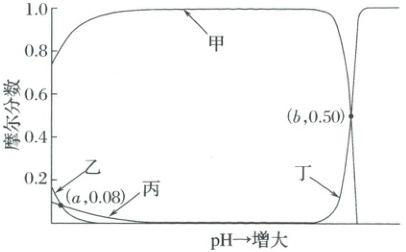
A.甲线所示物种为 $ HC_2O_4^- $
B.$ H_2C_2O_4 $ 的电离平衡常数 $ K_{a2} = 10^{-8} $
C.$ pH = a $ 时,$ Co^{2+} $ 物质的量浓度为 $ 1.6 × 10^{-3} \, mol · L^{-1} $
D.$ pH = b $ 时,物质的量浓度:$ c(OH^-) < c(C_2O_4^{2-}) $
CD
)
A.甲线所示物种为 $ HC_2O_4^- $
B.$ H_2C_2O_4 $ 的电离平衡常数 $ K_{a2} = 10^{-8} $
C.$ pH = a $ 时,$ Co^{2+} $ 物质的量浓度为 $ 1.6 × 10^{-3} \, mol · L^{-1} $
D.$ pH = b $ 时,物质的量浓度:$ c(OH^-) < c(C_2O_4^{2-}) $
答案:
3.CD$Co^{2+}$,$C_2O_4^{2-}$,初始浓度均为$0.01mol/L$,又$K_{sp}(CoC_2O_4)=6.0×10^{-8}$,且$pH$小时,无$Co(OH)_2$,所以开始时Co主要以$CoC_2O_4$形式存在,则含碳物种最多的为$CoC_2O_4$,即甲为$\delta(CoC_2O_4)$;随pH增大,$C_2O_4^{2-}$浓度增大,丁为$\delta(C_2O_4^{2-})$;pH越小,$c(H_2C_2O_4)$越大,则乙为$\delta(H_2C_2O_4)$,丙为$\delta(HC_2O_4^-)$;A错误;根据甲与丁的交点:$c(C_2O_4^{2-})=0.5×0.01=5×10^{-3}mol/L$
$c(CO^{2+})=\frac{K_{sp}(CoC_2O_4)}{c(C_2O_4^{2-})}=\frac{6.0×10^{-8}}{5×10^{-3}}=1.2×10^{-5}mol/L$,
$c^{2}(OH^-)=\frac{K_{sp}[Co(OH)_2]}{c(Co^{2+})}=\frac{5.9×10^{-15}}{1.2×10^{-5}}$,$c(OH^-)=\sqrt{5}×10^{-5}$,$K_{a2}=\frac{c(C_2O_4^{2-})·(CH^+)}{c(HC_2O_4^-)}$
$\frac{c(C_2O_4^{2-})×10^{-14}}{c(HC_2O_4^-)×\sqrt{5}×10^{-5}}\gg\frac{10×10^{-8}}{\sqrt{5}}$又$\frac{c(C_2O_4^{2-})}{c(HC_2O_4^-)}\gg1$,则B错误;$pH=a$时,$H_2C_2O_4$与$HC_2O_4^-$的摩尔分数均为$0.08$,$C_2O_4^{2-}$的摩尔分数几乎为$0$,则$CoC_2O_4$的摩尔分数为$1-2×0.08=0.84$,物质的量为$0.01mol×0.84=0.0084mol$,$pH=a$时,没有$Co(OH)_2$生成,因此剩余的Co元素均以$Co^{2+}$形式存在,$n(Co^{2+})=0.01mol-0.0084mol=1.6×10^{-3}mol$,则$c(Co^{2+})=\frac{1.6×10^{-3}mol}{1L}=1.6×10^{-3}mol·L^{-1}$,C正确;$pH=b$时,$C_2O_4^{2-}$和$CoC_2O_4$的摩尔分数均为$0.50$,则$n(C_2O_4^{2-})=n(CoC_2O_4)=0.01mol×0.50=5×10^{-3}mol$,$c(C_2O_4^{2-})=\frac{5×10^{-3}mol}{1L}=5×10^{-3}mol·L^{-1}$,此时部分$CoC_2O_4$转变为$Co(OH)_2$,溶液中存在平衡$CoC_2O_4+2OH^-\rightleftharpoonsCo(OH)_2+C_2O_4^{2-}$
$K=\frac{c(C_2O_4^{2-})}{c^{2}(OH^-)}=\frac{K_{sp}(CoC_2O_4)}{K_{sp}[Co(OH)_2]}\approx10^{7}$,代入$c(C_2O_4^{2-})=5×10^{-3}mol·L^{-1}$,解得$c(OH^-)\approx\sqrt{5}×10^{-5}mol·L^{-1}<c(C_2O_4^{2-})$,D正确。
$c(CO^{2+})=\frac{K_{sp}(CoC_2O_4)}{c(C_2O_4^{2-})}=\frac{6.0×10^{-8}}{5×10^{-3}}=1.2×10^{-5}mol/L$,
$c^{2}(OH^-)=\frac{K_{sp}[Co(OH)_2]}{c(Co^{2+})}=\frac{5.9×10^{-15}}{1.2×10^{-5}}$,$c(OH^-)=\sqrt{5}×10^{-5}$,$K_{a2}=\frac{c(C_2O_4^{2-})·(CH^+)}{c(HC_2O_4^-)}$
$\frac{c(C_2O_4^{2-})×10^{-14}}{c(HC_2O_4^-)×\sqrt{5}×10^{-5}}\gg\frac{10×10^{-8}}{\sqrt{5}}$又$\frac{c(C_2O_4^{2-})}{c(HC_2O_4^-)}\gg1$,则B错误;$pH=a$时,$H_2C_2O_4$与$HC_2O_4^-$的摩尔分数均为$0.08$,$C_2O_4^{2-}$的摩尔分数几乎为$0$,则$CoC_2O_4$的摩尔分数为$1-2×0.08=0.84$,物质的量为$0.01mol×0.84=0.0084mol$,$pH=a$时,没有$Co(OH)_2$生成,因此剩余的Co元素均以$Co^{2+}$形式存在,$n(Co^{2+})=0.01mol-0.0084mol=1.6×10^{-3}mol$,则$c(Co^{2+})=\frac{1.6×10^{-3}mol}{1L}=1.6×10^{-3}mol·L^{-1}$,C正确;$pH=b$时,$C_2O_4^{2-}$和$CoC_2O_4$的摩尔分数均为$0.50$,则$n(C_2O_4^{2-})=n(CoC_2O_4)=0.01mol×0.50=5×10^{-3}mol$,$c(C_2O_4^{2-})=\frac{5×10^{-3}mol}{1L}=5×10^{-3}mol·L^{-1}$,此时部分$CoC_2O_4$转变为$Co(OH)_2$,溶液中存在平衡$CoC_2O_4+2OH^-\rightleftharpoonsCo(OH)_2+C_2O_4^{2-}$
$K=\frac{c(C_2O_4^{2-})}{c^{2}(OH^-)}=\frac{K_{sp}(CoC_2O_4)}{K_{sp}[Co(OH)_2]}\approx10^{7}$,代入$c(C_2O_4^{2-})=5×10^{-3}mol·L^{-1}$,解得$c(OH^-)\approx\sqrt{5}×10^{-5}mol·L^{-1}<c(C_2O_4^{2-})$,D正确。
[例题分析]
$ 25^{\circ}C $ 时,往 $ 20.00 \, mL \, 0.1 \, mol · L^{-1} $ $ HA $ 溶液中滴入 $ 0.1 \, mol · L^{-1} $ $ NaOH $ 溶液,体系中 $ -lg \, c(HA) $、$ -lg \, c(A^-) $、$ NaOH $ 溶液的体积与溶液 $ pH $ 的关系如图所示。下列说法不正确的是(
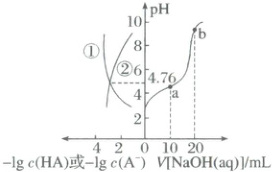
A.曲线①表示 $ -lg \, c(HA) $ 与溶液 $ pH $ 的关系
B.$ a $ 点对应的溶液中:$ 2c(H^+) + c(HA) = 2c(OH^-) + c(A^-) $
C.$ b $ 点对应的溶液中:$ c(Na^+) > c(A^-) > c(OH^-) > c(H^+) $
D.$ 25^{\circ}C $ 时,$ HA $ 的电离平衡常数的数量级为 $ 10^{-4} $
$ 25^{\circ}C $ 时,往 $ 20.00 \, mL \, 0.1 \, mol · L^{-1} $ $ HA $ 溶液中滴入 $ 0.1 \, mol · L^{-1} $ $ NaOH $ 溶液,体系中 $ -lg \, c(HA) $、$ -lg \, c(A^-) $、$ NaOH $ 溶液的体积与溶液 $ pH $ 的关系如图所示。下列说法不正确的是(
D
)
A.曲线①表示 $ -lg \, c(HA) $ 与溶液 $ pH $ 的关系
B.$ a $ 点对应的溶液中:$ 2c(H^+) + c(HA) = 2c(OH^-) + c(A^-) $
C.$ b $ 点对应的溶液中:$ c(Na^+) > c(A^-) > c(OH^-) > c(H^+) $
D.$ 25^{\circ}C $ 时,$ HA $ 的电离平衡常数的数量级为 $ 10^{-4} $
答案:
【答案】D
1. (2025·鄂东南省级示范高中教育改革联盟联考)常温下,$ M^{2+} $ 在不同 $ pH $ 的 $ Na_2A $ 溶液中的存在形式不同,有 $ M^{2+} $ 及难溶物 $ MA $、$ M(OH)_2 $ 等形式,$ Na_2A $ 溶液中 $ pM[pM = -lg \, c(M^{2+})] $、含 $ A $ 微粒的物质的量分数随 $ pH $ 的变化如图所示,下列说法正确的是(
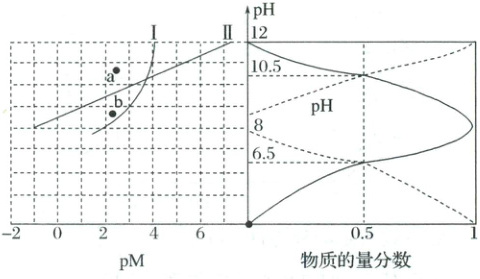
A.当 $ c(A^{2-}) = c(H_2A) $ 时,溶液的 $ pH = 8.0 $
B.$ 0.1 \, mol · L^{-1} \, Na_2A $ 与 $ 0.1 \, mol · L^{-1} \, NaHA $ 的混合溶液中存在:$ 2c(OH^-) - 2c(H^+) = c(A^{2-}) + c(HA^-) + 3c(H_2A) $
C.曲线Ⅱ上的点满足 $ c(M^{2+}) \, c(A^{2-}) = K_{sp}(MA) $
D.常温下 $ b $ 点,$ M^{2+} $ 在 $ Na_2A $ 溶液中不能生成 $ M(OH)_2 $ 沉淀
D
)
A.当 $ c(A^{2-}) = c(H_2A) $ 时,溶液的 $ pH = 8.0 $
B.$ 0.1 \, mol · L^{-1} \, Na_2A $ 与 $ 0.1 \, mol · L^{-1} \, NaHA $ 的混合溶液中存在:$ 2c(OH^-) - 2c(H^+) = c(A^{2-}) + c(HA^-) + 3c(H_2A) $
C.曲线Ⅱ上的点满足 $ c(M^{2+}) \, c(A^{2-}) = K_{sp}(MA) $
D.常温下 $ b $ 点,$ M^{2+} $ 在 $ Na_2A $ 溶液中不能生成 $ M(OH)_2 $ 沉淀
答案:
1.D$H_2A$的电离方程式为:$H_2A\rightleftharpoonsH^++HA^-$,$HA^-\rightleftharpoonsH^++A^{2-}$;由图可知,当$pH=6.5$时,表示溶液中$c(HA^-)=c(H_2A)$,则$H_2A$的电离平衡常数:$K_{a1}=\frac{c(H^+)· c(HA^-)}{c(H_2A)}=1×10^{-6.5}$;当$pH=10.5$时,表示溶液中$c(A^{2-})=c(HA^-)$,则$HA^-$的电离平衡常数:$K_{a2}=\frac{c(H^+)· c(A^{2-})}{c(HA^-)}=1×10^{-10.5}$。
A项,当$c(A^{2-})=c(H_2A)$时,代入$K_{a1}· K_{a2}$的表达式中得$K_{a1}· K_{a2}=\frac{c(H^+)· c(HA^-)}{c(H_2A)}×\frac{c(H^+)· c(A^{2-})}{c(HA^-)}$,化简得$c^{2}(H^+)=1×10^{-6.5}×1×10^{-10.5}=1×10^{-17}$,解得$c(H^+)=1×10^{-8.5}mol·L^{-1}$,可得出溶液的$pH=8.5$,A错误;
B项,由电荷守恒:$c(Na^+)+c(H^+)=c(OH^-)+2c(A^{2-})+c(HA^-)$和元素质量守恒:$2c(Na^+)=3[c(A^{2-})+c(HA^-)+c(H_2A)]$,求解得到:$2c(OH^-)-2c(H^+)+c(A^{2-})=c(HA^-)+3c(H_2A)$,B错误;
C项,由$K_{sp}[M(OH)_2]=c(M^{2+})· c^{2}(OH^-)$可得$c(M^{2+})=\frac{K_{sp}[M(OH)_2]}{c^{2}(OH^-)}=\frac{K_{sp}[M(OH)_2]}{[\frac{1×10^{-14}}{c(H^+)}]^2}=\frac{c^{2}(H^+)· K_{sp}[M(OH)_2]}{1×10^{-28}}$,则$pM=-\lg c(M^{2+})=2pH-\lg K_{sp}[M(OH)_2]-28$,图像Ⅱ是直线,故曲线Ⅱ表示$M(OH)_2$的溶解平衡曲线,曲线Ⅰ表示$MA$的溶解平衡曲线,C错误;
D项,曲线Ⅱ上的点满足$c(M^{2+})· c^{2}(OH^-)=K_{sp}[M(OH)_2]$,而b点在曲线Ⅱ的下方,$c(OH^-)$比平衡时小,故$M^{2+}$在$Na_2A$溶液中不能生成$M(OH)_2$沉淀,D正确;故选D。
A项,当$c(A^{2-})=c(H_2A)$时,代入$K_{a1}· K_{a2}$的表达式中得$K_{a1}· K_{a2}=\frac{c(H^+)· c(HA^-)}{c(H_2A)}×\frac{c(H^+)· c(A^{2-})}{c(HA^-)}$,化简得$c^{2}(H^+)=1×10^{-6.5}×1×10^{-10.5}=1×10^{-17}$,解得$c(H^+)=1×10^{-8.5}mol·L^{-1}$,可得出溶液的$pH=8.5$,A错误;
B项,由电荷守恒:$c(Na^+)+c(H^+)=c(OH^-)+2c(A^{2-})+c(HA^-)$和元素质量守恒:$2c(Na^+)=3[c(A^{2-})+c(HA^-)+c(H_2A)]$,求解得到:$2c(OH^-)-2c(H^+)+c(A^{2-})=c(HA^-)+3c(H_2A)$,B错误;
C项,由$K_{sp}[M(OH)_2]=c(M^{2+})· c^{2}(OH^-)$可得$c(M^{2+})=\frac{K_{sp}[M(OH)_2]}{c^{2}(OH^-)}=\frac{K_{sp}[M(OH)_2]}{[\frac{1×10^{-14}}{c(H^+)}]^2}=\frac{c^{2}(H^+)· K_{sp}[M(OH)_2]}{1×10^{-28}}$,则$pM=-\lg c(M^{2+})=2pH-\lg K_{sp}[M(OH)_2]-28$,图像Ⅱ是直线,故曲线Ⅱ表示$M(OH)_2$的溶解平衡曲线,曲线Ⅰ表示$MA$的溶解平衡曲线,C错误;
D项,曲线Ⅱ上的点满足$c(M^{2+})· c^{2}(OH^-)=K_{sp}[M(OH)_2]$,而b点在曲线Ⅱ的下方,$c(OH^-)$比平衡时小,故$M^{2+}$在$Na_2A$溶液中不能生成$M(OH)_2$沉淀,D正确;故选D。
查看更多完整答案,请扫码查看


