2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第65页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·陕晋青卷)一种综合回收电解锰工业废盐(主要成分为$Mn^{2+}$、$Mg^{2+}$、$NH_{4}^{+}$的硫酸盐)的工艺流程如下。
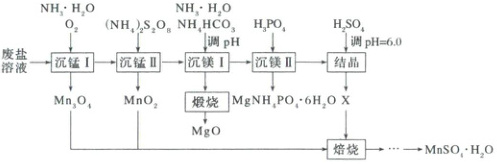
已知:①常温下$K_{sp}(MgCO_{3}) = 10^{-5.17}$,$K_{sp}[Mg(OH)_{2}] = 10^{-11.25}$,$K_{sp}[Mn(OH)_{2}] = 10^{-12.72}$;
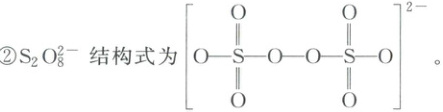
②$S_{2}O_{8}^{2-}$结构式为$\begin{bmatrix}\begin{array}{c}O\\\vert\\O - S - O - O - S - O\\\vert\\O\end{array}\end{bmatrix}^{2 - }$。
回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有
(2)“沉锰Ⅰ”中,写出形成的$Mn(OH)_{2}$被氧化成$Mn_{3}O_{4}$的化学方程式:
(3)“沉锰Ⅱ”中,过量的$(NH_{4})_{2}S_{2}O_{8}$经加热水解去除,最终产物是$NH_{4}HSO_{4}$和
(4)“沉镁Ⅰ”中,当$pH$为$8.0\sim10.2$时,生成碱式碳酸镁$[xMgCO_{3}·yMg(OH)_{2}·zH_{2}O]$,煅烧得到疏松的轻质$MgO$。$pH$过大时,不能得到轻质$MgO$的原因是_。
(5)“沉镁Ⅱ”中,加$H_{3}PO_{4}$至$pH = 8.0$时,$Mg^{2 + }$沉淀完全;若加至$pH = 4.0$时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式:_。
(6)“结晶”中,产物$X$的化学式为________________________。
(7)“焙烧”中,$Mn$元素发生了


已知:①常温下$K_{sp}(MgCO_{3}) = 10^{-5.17}$,$K_{sp}[Mg(OH)_{2}] = 10^{-11.25}$,$K_{sp}[Mn(OH)_{2}] = 10^{-12.72}$;
②$S_{2}O_{8}^{2-}$结构式为$\begin{bmatrix}\begin{array}{c}O\\\vert\\O - S - O - O - S - O\\\vert\\O\end{array}\end{bmatrix}^{2 - }$。
回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有
适当加热
、搅拌
(写出两种)。(2)“沉锰Ⅰ”中,写出形成的$Mn(OH)_{2}$被氧化成$Mn_{3}O_{4}$的化学方程式:
6Mn(OH)_2 + O_2 = 2Mn_3O_4 + 6H_2O
。当$Mg^{2 + }(c = 10^{-0.68}mol·L^{-1})$将要开始沉淀时,溶液中剩余$Mn^{2 + }$浓度为10^{-2.15}
$mol·L^{-1}$。(3)“沉锰Ⅱ”中,过量的$(NH_{4})_{2}S_{2}O_{8}$经加热水解去除,最终产物是$NH_{4}HSO_{4}$和
O_2
(填化学式)。(4)“沉镁Ⅰ”中,当$pH$为$8.0\sim10.2$时,生成碱式碳酸镁$[xMgCO_{3}·yMg(OH)_{2}·zH_{2}O]$,煅烧得到疏松的轻质$MgO$。$pH$过大时,不能得到轻质$MgO$的原因是_。
(5)“沉镁Ⅱ”中,加$H_{3}PO_{4}$至$pH = 8.0$时,$Mg^{2 + }$沉淀完全;若加至$pH = 4.0$时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式:_。
(6)“结晶”中,产物$X$的化学式为________________________。
(7)“焙烧”中,$Mn$元素发生了
还原
(填“氧化”或“还原”)反应。

答案:
1.
(1)适当加热 搅拌(或将废盐固体粉碎等,写出两种即可)
(2)$6Mn(OH)_2 + O_2 = 2Mn_3O_4 + 6H_2O$ $10^{-2.15}$
(3)$O_2$
(4)pH过大时,沉淀中$MgCO_3$的比例降低,煅烧产生的$CO_2$气体减少,故得不到疏松的轻质$MgO$
(5)$MgHPO_4 + H_3PO_4 = Mg^{2+} + 2H_2PO_4^-$
(6)$(NH_4)_2SO_4$
(7)还原
(1)适当加热 搅拌(或将废盐固体粉碎等,写出两种即可)
(2)$6Mn(OH)_2 + O_2 = 2Mn_3O_4 + 6H_2O$ $10^{-2.15}$
(3)$O_2$
(4)pH过大时,沉淀中$MgCO_3$的比例降低,煅烧产生的$CO_2$气体减少,故得不到疏松的轻质$MgO$
(5)$MgHPO_4 + H_3PO_4 = Mg^{2+} + 2H_2PO_4^-$
(6)$(NH_4)_2SO_4$
(7)还原
2. (2025·江苏卷)$ZnS$可用于制备光学材料和回收砷。
(1)制备$ZnS$。由闪锌矿[含$ZnS$、$FeS$及少量硫化镉($CdS$)等]制备$ZnS$的过程如下:

已知:$K_{sp}(ZnS) = 1.6×10^{-24}$,$K_{sp}(CdS) = 8.0×10^{-27}$,$K_{a1}(H_{2}S) = 1.0×10^{-7}$,$K_{a2}(H_{2}S) = 1.2×10^{-13}$。当离子浓度小于$1.0×10^{-5}mol·L^{-1}$时,认为离子沉淀完全。
①酸浸时通入$O_{2}$可提高$Zn^{2 + }$浸出率的原因是_。
②通入$H_{2}S$除镉。通过计算判断当溶液$pH = 0$、$c(H_{2}S) = 0.01mol·L^{-1}$时,$Cd^{2 + }$是否沉淀完全
③沉锌前调节溶液的$pH$至$4\sim5$,加入的氧化物为
(2)制备光学材料。如图所示,$ZnS$晶体中掺入少量$CuCl$后,会出现能量不同的“正电”区域、“负电”区域,光照下发出特定波长的光。
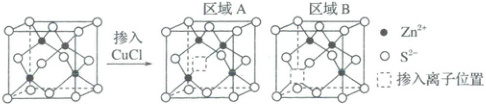
区域$A$“$·s$”中的离子为
(3)回收砷。用$ZnS$去除酸性废液中的三价砷$[As(Ⅲ)]$,并回收生成的$As_{2}S_{3}$沉淀。
已知:溶液中$As(Ⅲ)$主要以弱酸$H_{3}AsO_{3}$形式存在,$As_{2}S_{3} + 6H_{2}O\rightleftharpoons 2H_{3}AsO_{3} + 3H_{2}S$。
$60^{\circ}C$时,按$n(S):n(As) = 7:1$向酸性废液中加入$ZnS$,砷回收率随反应时间的变化如图所示。
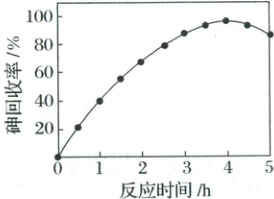
①写出$ZnS$与$H_{3}AsO_{3}$反应生成$As_{2}S_{3}$的离子方程式:_。
②反应$4h$后,砷回收率下降的原因有_。
(1)制备$ZnS$。由闪锌矿[含$ZnS$、$FeS$及少量硫化镉($CdS$)等]制备$ZnS$的过程如下:

已知:$K_{sp}(ZnS) = 1.6×10^{-24}$,$K_{sp}(CdS) = 8.0×10^{-27}$,$K_{a1}(H_{2}S) = 1.0×10^{-7}$,$K_{a2}(H_{2}S) = 1.2×10^{-13}$。当离子浓度小于$1.0×10^{-5}mol·L^{-1}$时,认为离子沉淀完全。
①酸浸时通入$O_{2}$可提高$Zn^{2 + }$浸出率的原因是_。
②通入$H_{2}S$除镉。通过计算判断当溶液$pH = 0$、$c(H_{2}S) = 0.01mol·L^{-1}$时,$Cd^{2 + }$是否沉淀完全
溶液中$c(H^+) = 1 mol· L^{-1}$,$K_{a1}(H_2S) · K_{a2}(H_2S) = \frac{c^2(H^+) · c(S^{2-})}{c(H_2S)} = 1.0 × 10^{-7} × 1.2 × 10^{-13} = 1.2 × 10^{-20}$,$c(H_2S) = 0.01 mol· L^{-1}$,$c(S^{2-}) = 1.2 × 10^{-22} mol· L^{-1}$,$K_{sp}(CdS) = c(Cd^{2+}) · c(S^{2-}) = 8.0 × 10^{-27}$,$c(Cd^{2+}) \approx 6.67 × 10^{-5} mol· L^{-1} > 1.0 × 10^{-5} mol· L^{-1}$,故$Cd^{2+}$未沉淀完全
(写出计算过程)。③沉锌前调节溶液的$pH$至$4\sim5$,加入的氧化物为
ZnO
(填化学式)。(2)制备光学材料。如图所示,$ZnS$晶体中掺入少量$CuCl$后,会出现能量不同的“正电”区域、“负电”区域,光照下发出特定波长的光。

区域$A$“$·s$”中的离子为
Cl^-
(填离子符号),区域$B$带负电
(填“正电”或“负电”)。(3)回收砷。用$ZnS$去除酸性废液中的三价砷$[As(Ⅲ)]$,并回收生成的$As_{2}S_{3}$沉淀。
已知:溶液中$As(Ⅲ)$主要以弱酸$H_{3}AsO_{3}$形式存在,$As_{2}S_{3} + 6H_{2}O\rightleftharpoons 2H_{3}AsO_{3} + 3H_{2}S$。
$60^{\circ}C$时,按$n(S):n(As) = 7:1$向酸性废液中加入$ZnS$,砷回收率随反应时间的变化如图所示。

①写出$ZnS$与$H_{3}AsO_{3}$反应生成$As_{2}S_{3}$的离子方程式:_。
②反应$4h$后,砷回收率下降的原因有_。
答案:
2.
(1)①氧化$S^{2-}$生成S,促进酸浸反应正向进行;将$FeS$转化为$Fe_2(SO_4)_3$,促使$ZnS$氧化成$ZnSO_4$ ②溶液中$c(H^+) = 1 mol· L^{-1}$,$K_{a1}(H_2S) · K_{a2}(H_2S) = \frac{c^2(H^+) · c(S^{2-})}{c(H_2S)} = 1.0 × 10^{-7} × 1.2 × 10^{-13} = 1.2 × 10^{-20}$,$c(H_2S) = 0.01 mol· L^{-1}$,$c(S^{2-}) = 1.2 × 10^{-22} mol· L^{-1}$,$K_{sp}(CdS) = c(Cd^{2+}) · c(S^{2-}) = 8.0 × 10^{-27}$,$c(Cd^{2+}) \approx 6.67 × 10^{-5} mol· L^{-1} > 1.0 × 10^{-5} mol· L^{-1}$,故$Cd^{2+}$未沉淀完全 ③$ZnO$
(2)$Cl^-$ 负电
(3)①$3ZnS + 2H_3AsO_3 + 6H^+ \xlongequal{60° C} As_2S_3 + 3Zn^{2+} + 6H_2O$ ②$c(H^+)$减小,反应速率降低;$As_2S_3 + 6H_2O \rightleftharpoons 2H_3AsO_3 + 3H_2S$平衡正向移动,$As_2S_3$转化为$H_3AsO_3$进入溶液
(1)①氧化$S^{2-}$生成S,促进酸浸反应正向进行;将$FeS$转化为$Fe_2(SO_4)_3$,促使$ZnS$氧化成$ZnSO_4$ ②溶液中$c(H^+) = 1 mol· L^{-1}$,$K_{a1}(H_2S) · K_{a2}(H_2S) = \frac{c^2(H^+) · c(S^{2-})}{c(H_2S)} = 1.0 × 10^{-7} × 1.2 × 10^{-13} = 1.2 × 10^{-20}$,$c(H_2S) = 0.01 mol· L^{-1}$,$c(S^{2-}) = 1.2 × 10^{-22} mol· L^{-1}$,$K_{sp}(CdS) = c(Cd^{2+}) · c(S^{2-}) = 8.0 × 10^{-27}$,$c(Cd^{2+}) \approx 6.67 × 10^{-5} mol· L^{-1} > 1.0 × 10^{-5} mol· L^{-1}$,故$Cd^{2+}$未沉淀完全 ③$ZnO$
(2)$Cl^-$ 负电
(3)①$3ZnS + 2H_3AsO_3 + 6H^+ \xlongequal{60° C} As_2S_3 + 3Zn^{2+} + 6H_2O$ ②$c(H^+)$减小,反应速率降低;$As_2S_3 + 6H_2O \rightleftharpoons 2H_3AsO_3 + 3H_2S$平衡正向移动,$As_2S_3$转化为$H_3AsO_3$进入溶液
查看更多完整答案,请扫码查看


