2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·河南卷)在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为CH₃CH₂CH₃(g)⇌CH₃CH=CH₂(g)+H₂(g),反应进程中的相对能量变化如图所示(*表示吸附态,*CH₃CHCH₂+2*H→CH₃CH=CH₂(g)+H₂(g)中部分进程已省略)。

下列说法正确的是(
A.总反应是放热反应
B.两种不同催化剂作用下总反应的化学平衡常数不同
C.和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D.①转化为②的进程中,决速步骤为*CH₃CH₂CH₃→*CH₃CHCH₃+*H

下列说法正确的是(
C
)A.总反应是放热反应
B.两种不同催化剂作用下总反应的化学平衡常数不同
C.和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D.①转化为②的进程中,决速步骤为*CH₃CH₂CH₃→*CH₃CHCH₃+*H
答案:
1.C 由图可知,生成物能量高,总反应为吸热反应,A错误;化学平衡常数只与温度有关,而与其他条件无关,因此两种不同催化剂作用下总反应的化学平衡常数相同,B错误;反应的决速步骤为活化能最大的步骤,即反应进行最慢的步骤,由图像可以看出,在①转化为②的进程中,$\mathrm{^*CH_3CHCH_3+^*H \longrightarrow ^*CH_3CHCH_2+2^*H}$的活化能最大,因此①转化为②的进程中,决速步骤为$\mathrm{^*CH_3CHCH_3+^*H \longrightarrow ^*CH_3CHCH_2+2^*H}$(或写为$\mathrm{^*CH_3CHCH_3 \longrightarrow ^*CH_3CHCH_2+^*H}$),D错误。
2. (2025·河北卷)氮化镓(GaN)是一种重要的半导体材料,广泛应用于光电信息材料等领域,可利用反应Ga₂O₃(s)+2NH₃(g)⇌2GaN(s)+3H₂O(g)制备。反应历程(TS代表过渡态)如下:
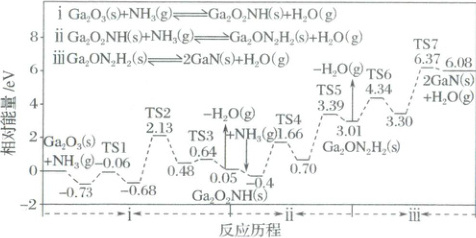
下列说法错误的是(
A.反应ⅰ是吸热过程
B.反应ⅱ中H₂O(g)脱去步骤的活化能为2.69eV
C.反应ⅲ包含2个基元反应
D.总反应的速控步包含在反应ⅱ中

下列说法错误的是(
D
)A.反应ⅰ是吸热过程
B.反应ⅱ中H₂O(g)脱去步骤的活化能为2.69eV
C.反应ⅲ包含2个基元反应
D.总反应的速控步包含在反应ⅱ中
答案:
2.D 由反应历程图可知,反应i反应后相对能量增加0.05eV,体系能量升高,故反应i为吸热反应,A正确;由图可知,反应ii中$\mathrm{H_2O(g)}$脱去的步骤即反应ii的最后一步的活化能为3.39eV−0.70eV=2.69eV,B正确;反应iii历程中存在两个过渡态,故包含2个基元反应,C正确;由图可知,整个反应历程中,活化能最高的步骤是反应iii中的TS7对应的步骤,其活化能为6.37eV−3.30eV=3.07eV,故D错误。
3. (2025·广东卷)某理论研究认为:燃料电池(图b)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图a和图c,其中O₂获得第一个电子的过程最慢。由此可知,理论上(

A.负极反应的催化剂是ⅰ
B.图a中,ⅰ到ⅱ过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
C
)
A.负极反应的催化剂是ⅰ
B.图a中,ⅰ到ⅱ过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
答案:
3.C 由图a知,电极I发生的反应为$\mathrm{O_2 + 4H^+ + 4e^- = 2H_2O}$,故电极I作正极,由图c知,电极II发生的反应为$\mathrm{H_2 - 2e^- = 2H^+}$,故电极II作负极。结合上述分析知,正极反应的催化剂是i,A错误;由$\mathrm{O_2}$获得第一个电子的过程最慢知,i到ii过程的活化能最大,B错误;$\mathrm{H_2}$进入负极失电子生成$\mathrm{H^+}$,为保持溶液呈电中性,$\mathrm{H^+}$通过质子交换膜向正极迁移,故负极室的溶液质量保持不变,C正确;根据正、负极的电极反应式及得失电子恒知,相同时间内电极II上催化循环完成次数为电极I上的2倍,D错误。
4. (2024·甘肃卷)甲烷在某含Mo催化剂作用下部分反应的能量变化如图所示,下列说法错误的是(

A.E₂=1.41eV
B.步骤2逆向反应的ΔH=+0.29eV
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
C
)
A.E₂=1.41eV
B.步骤2逆向反应的ΔH=+0.29eV
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
答案:
4.C 由能量变化图可知,$E_2=0.70 eV-(-0.71 eV)=1.41 eV$,A项正确;由$\Delta H=$生成物总能量−反应物总能量知,步骤2逆向反应的$\Delta H=-0.71 eV-(-1.00 eV)=+0.29 eV$,B项正确;由能量变化图可知,步骤1的活化能($E_1$)大于步骤2的活化能($E_3$),则步骤1的反应比步骤2慢,C项错误;该过程中甲烷转化为甲醇,实现了甲烷的氧化,D项正确。
查看更多完整答案,请扫码查看


