2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·陕晋青宁卷)常温下,溶液中$Al^{3+}$、$Zn^{2+}$、$Cd^{2+}$以氢氧化物形式沉淀时,$-lg[c(X)/(mol· L^{-1})]$与$-lg[c(H^{+})/(mol· L^{-1})]$的关系如图[其中X代表$Al^{3+}$、$Zn^{2+}$、$Cd^{2+}$、$Al(OH)_{4}^{-}$、$Zn(OH)_{4}^{2-}$或$Cd(OH)_{4}^{2-}$。已知:$K_{sp}[Zn(OH)_{2}]<K_{sp}[Cd(OH)_{2}]$,$Zn(OH)_{2}$比$Cd(OH)_{2}$更易与碱反应,形成$M(OH)_{4}^{2-}$;溶液中$c(X)\leq10^{-5}mol· L^{-1}$时,X可忽略不计。
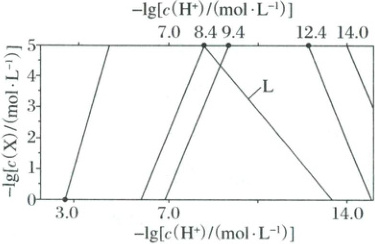
下列说法错误的是(
A.L为$-lgc[Al(OH)_{4}^{-}]$与$-lgc(H^{+})$的关系曲线
B.$Zn^{2+}+4OH^{-}=Zn(OH)_{4}^{2-}$的平衡常数为$10^{11.2}$
C.调节NaOH溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$
D.调节溶液pH为4.7~6.4,可将浓度均为$0.1mol· L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离

下列说法错误的是(
B
)A.L为$-lgc[Al(OH)_{4}^{-}]$与$-lgc(H^{+})$的关系曲线
B.$Zn^{2+}+4OH^{-}=Zn(OH)_{4}^{2-}$的平衡常数为$10^{11.2}$
C.调节NaOH溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$
D.调节溶液pH为4.7~6.4,可将浓度均为$0.1mol· L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离
答案:
1.B根据$Zn(OH)_{2}$与$Cd(OH)_{2}$,$[Zn(OH)_{4}]^{2-}$与$[Cd(OH)_{4}]^{2-}$斜率均相同,可判断L为$-\lg c[Al(OH)_{4}]^{-}$与$-\lg c(H^{+})$的关系曲线,A正确;由点$(8.4,5)$可知$K_{sp}[Zn(OH)_{2}]=10^{-5}×(10^{-5.6})^{2}=10^{-16.2}$,根据$c[Zn(OH)_{4}^{2-}]=10^{-5} mol·L^{-1}$时,$-\lg c(H^{+})=12.4$,知$c(OH^{-}) =10^{-1.6} mol·L^{-1}$,则$Zn^{2+}+4OH^{-}\rightleftharpoons[Zn(OH)_{4}]^{2-}$的平衡常数$K=\frac{c[Zn(OH)_{4}^{2-}]}{c(Zn^{2+})· c^{4}(OH^{-})}=\frac{c[Zn(OH)_{4}^{2-}]}{K_{sp}[Zn(OH)_{2}]· c^{2}(OH^{-})}=\frac{10^{-5}}{10^{-16.2}×(10^{-1.6})^{2}}=10^{14.4}$ ,B错误;$Al(OH)_{3}$完全溶解的$pH$小于$14.0$,而$Cd(OH)_{2}$开始溶解的$pH$为$14.0$,故调节$NaOH$溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$
,B错误;$Al(OH)_{3}$完全溶解的$pH$小于$14.0$,而$Cd(OH)_{2}$开始溶解的$pH$为$14.0$,故调节$NaOH$溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$ ,C正确;由点$(3.0,0)$可知,$K_{sp}[Al(OH)_{3}]=1×(10^{-11})^{3}=10^{-33}$,浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$,$Al^{3+}$完全沉淀时$c(OH^{-})=\sqrt[3]{\frac{10^{-33}}{10^{-5}}} mol·L^{-1}\approx10^{-9.3} mol·L^{-1}$,此时$pH=4.7$,$Zn^{2+}$开始沉淀时$c(OH^{-})=\sqrt{\frac{10^{-16.2}}{0.1}} mol·L^{-1}=10^{-7.6} mol·L^{-1}$,此时$pH=6.4$,因此调节溶液$pH$为$4.7\sim6.4$,可将浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离,D正确。
,C正确;由点$(3.0,0)$可知,$K_{sp}[Al(OH)_{3}]=1×(10^{-11})^{3}=10^{-33}$,浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$,$Al^{3+}$完全沉淀时$c(OH^{-})=\sqrt[3]{\frac{10^{-33}}{10^{-5}}} mol·L^{-1}\approx10^{-9.3} mol·L^{-1}$,此时$pH=4.7$,$Zn^{2+}$开始沉淀时$c(OH^{-})=\sqrt{\frac{10^{-16.2}}{0.1}} mol·L^{-1}=10^{-7.6} mol·L^{-1}$,此时$pH=6.4$,因此调节溶液$pH$为$4.7\sim6.4$,可将浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离,D正确。
1.B根据$Zn(OH)_{2}$与$Cd(OH)_{2}$,$[Zn(OH)_{4}]^{2-}$与$[Cd(OH)_{4}]^{2-}$斜率均相同,可判断L为$-\lg c[Al(OH)_{4}]^{-}$与$-\lg c(H^{+})$的关系曲线,A正确;由点$(8.4,5)$可知$K_{sp}[Zn(OH)_{2}]=10^{-5}×(10^{-5.6})^{2}=10^{-16.2}$,根据$c[Zn(OH)_{4}^{2-}]=10^{-5} mol·L^{-1}$时,$-\lg c(H^{+})=12.4$,知$c(OH^{-}) =10^{-1.6} mol·L^{-1}$,则$Zn^{2+}+4OH^{-}\rightleftharpoons[Zn(OH)_{4}]^{2-}$的平衡常数$K=\frac{c[Zn(OH)_{4}^{2-}]}{c(Zn^{2+})· c^{4}(OH^{-})}=\frac{c[Zn(OH)_{4}^{2-}]}{K_{sp}[Zn(OH)_{2}]· c^{2}(OH^{-})}=\frac{10^{-5}}{10^{-16.2}×(10^{-1.6})^{2}}=10^{14.4}$
 ,B错误;$Al(OH)_{3}$完全溶解的$pH$小于$14.0$,而$Cd(OH)_{2}$开始溶解的$pH$为$14.0$,故调节$NaOH$溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$
,B错误;$Al(OH)_{3}$完全溶解的$pH$小于$14.0$,而$Cd(OH)_{2}$开始溶解的$pH$为$14.0$,故调节$NaOH$溶液浓度,通过碱浸可完全分离$Cd(OH)_{2}$和$Al(OH)_{3}$ ,C正确;由点$(3.0,0)$可知,$K_{sp}[Al(OH)_{3}]=1×(10^{-11})^{3}=10^{-33}$,浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$,$Al^{3+}$完全沉淀时$c(OH^{-})=\sqrt[3]{\frac{10^{-33}}{10^{-5}}} mol·L^{-1}\approx10^{-9.3} mol·L^{-1}$,此时$pH=4.7$,$Zn^{2+}$开始沉淀时$c(OH^{-})=\sqrt{\frac{10^{-16.2}}{0.1}} mol·L^{-1}=10^{-7.6} mol·L^{-1}$,此时$pH=6.4$,因此调节溶液$pH$为$4.7\sim6.4$,可将浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离,D正确。
,C正确;由点$(3.0,0)$可知,$K_{sp}[Al(OH)_{3}]=1×(10^{-11})^{3}=10^{-33}$,浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$,$Al^{3+}$完全沉淀时$c(OH^{-})=\sqrt[3]{\frac{10^{-33}}{10^{-5}}} mol·L^{-1}\approx10^{-9.3} mol·L^{-1}$,此时$pH=4.7$,$Zn^{2+}$开始沉淀时$c(OH^{-})=\sqrt{\frac{10^{-16.2}}{0.1}} mol·L^{-1}=10^{-7.6} mol·L^{-1}$,此时$pH=6.4$,因此调节溶液$pH$为$4.7\sim6.4$,可将浓度均为$0.1 mol·L^{-1}$的$Zn^{2+}$和$Al^{3+}$完全分离,D正确。 2. (2025·安徽卷)$H_{2}A$是二元弱酸,$M^{2+}$不发生水解。25℃时,向足量的难溶盐MA粉末中加入稀盐酸,平衡时溶液中$lg[c(M^{2+})/(mol· L^{-1})]$与pH的关系如图所示。
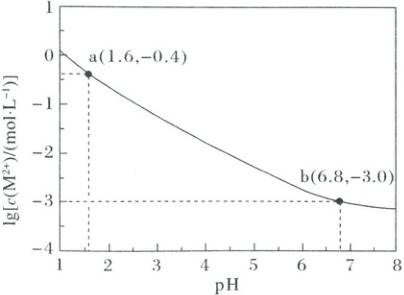
已知25℃时,$K_{a1}(H_{2}A)=10^{-1.6}$,$K_{a2}(H_{2}A)=10^{-6.8}$,$lg2=0.3$。下列说法正确的是(
A.25℃时,MA的溶度积常数$K_{sp}(MA)=10^{-6.3}$
B.$pH=1.6$时,溶液中$c(M^{2+})>c(Cl^{-})>c(HA^{-})>c(A^{2-})$
C.$pH=4.5$时,溶液中$c(HA^{-})>c(H_{2}A)>c(A^{2-})$
D.$pH=6.8$时,溶液中$c(H^{+})+2c(HA^{-})+c(H_{2}A)=c(OH^{-})+c(Cl^{-})$

已知25℃时,$K_{a1}(H_{2}A)=10^{-1.6}$,$K_{a2}(H_{2}A)=10^{-6.8}$,$lg2=0.3$。下列说法正确的是(
A
)A.25℃时,MA的溶度积常数$K_{sp}(MA)=10^{-6.3}$
B.$pH=1.6$时,溶液中$c(M^{2+})>c(Cl^{-})>c(HA^{-})>c(A^{2-})$
C.$pH=4.5$时,溶液中$c(HA^{-})>c(H_{2}A)>c(A^{2-})$
D.$pH=6.8$时,溶液中$c(H^{+})+2c(HA^{-})+c(H_{2}A)=c(OH^{-})+c(Cl^{-})$
答案:
2.A根据题意知,平衡时溶液中存在元素质量守恒$c(M^{2+})=c(A^{2-})+c(HA^{-})+c(H_{2}A)$和电荷守恒$2c(M^{2+})+c(H^{+})=c(Cl^{-})+2c(A^{2-})+c(HA^{-})+c(OH^{-})$,根据$K_{a1}=\frac{c(H^{+})· c(HA^{-})}{c(H_{2}A)}$、$K_{a2}=\frac{c(H^{+})· c(A^{2-})}{c(HA^{-})}$及a点和b点数据知,a点处$c(HA^{-})=c(H_{2}A)$,且$pH$较小时$A^{2-}$可忽略不计,b点处$c(A^{2-})=c(HA^{-})$,且$pH$较大时$H_{2}A$可忽略不计。
由上述分析知,利用b点数据计算$MA$的溶度积常数,b点处$c(M^{2+})=10^{-3.0} mol·L^{-1}$,根据元素质量守恒$c(M^{2+})=c(A^{2-})+c(HA^{-})+c(H_{2}A)=2c(A^{2-})$知,$c(A^{2-})=0.5×10^{-3.0} mol·L^{-1}$,故$K_{sp}(MA)=c(M^{2+})· c(A^{2-})=10^{-3.0}×0.5×10^{-3.0}=\frac{1}{10^{0.3}}×10^{-6}=10^{-6.3}$,A正确;$pH=1.6$时,$c(H^{+})>c(OH^{-})$,$c(M^{2+})=10^{-0.4} mol·L^{-1}$,$c(HA^{-})=\frac{10^{-0.4}}{2} mol·L^{-1}$,代入电荷守恒式知,$c(Cl^{-})>1.5×10^{-0.4} mol·L^{-1}>c(M^{2+})$,故B错误;$pH=4.5$时,溶液中$c(H^{+})=10^{-4.5} mol·L^{-1}$,由$K_{a1}(H_{2}A)=\frac{c(H^{+})· c(HA^{-})}{c(H_{2}A)}$,知$\frac{c(HA^{-})}{c(H_{2}A)}=10^{2.9}>1$,故$c(HA^{-})>c(H_{2}A)$,由$K_{a2}(H_{2}A)=\frac{c(H^{+})· c(A^{2-})}{c(HA^{-})}$,知$\frac{c(A^{2-})}{c(HA^{-})}=10^{-2.3}<1$,故$c(HA^{-})>c(A^{2-})$,由$K_{a1}(H_{2}A)· K_{a2}(H_{2}A)=\frac{c^{2}(H^{+})· c(A^{2-})}{c(H_{2}A)}$,知$\frac{c(A^{2-})}{c(H_{2}A)}=10^{0.6}>1$,故$c(A^{2-})>c(H_{2}A)$,即溶液中$c(HA^{-})>c(A^{2-})>c(H_{2}A)$,C错误;$pH=6.8$时,联立电荷守恒$c(H^{+})+2c(M^{2+})=c(OH^{-})+c(Cl^{-})+c(HA^{-})+2c(A^{2-})$和元素质量守恒$c(M^{2+})=c(H_{2}A)+c(HA^{-})+c(A^{2-})$,可得质子守恒:$c(H^{+})+2c(H_{2}A)+c(HA^{-})=c(OH^{-})+c(Cl^{-})$,D错误。
由上述分析知,利用b点数据计算$MA$的溶度积常数,b点处$c(M^{2+})=10^{-3.0} mol·L^{-1}$,根据元素质量守恒$c(M^{2+})=c(A^{2-})+c(HA^{-})+c(H_{2}A)=2c(A^{2-})$知,$c(A^{2-})=0.5×10^{-3.0} mol·L^{-1}$,故$K_{sp}(MA)=c(M^{2+})· c(A^{2-})=10^{-3.0}×0.5×10^{-3.0}=\frac{1}{10^{0.3}}×10^{-6}=10^{-6.3}$,A正确;$pH=1.6$时,$c(H^{+})>c(OH^{-})$,$c(M^{2+})=10^{-0.4} mol·L^{-1}$,$c(HA^{-})=\frac{10^{-0.4}}{2} mol·L^{-1}$,代入电荷守恒式知,$c(Cl^{-})>1.5×10^{-0.4} mol·L^{-1}>c(M^{2+})$,故B错误;$pH=4.5$时,溶液中$c(H^{+})=10^{-4.5} mol·L^{-1}$,由$K_{a1}(H_{2}A)=\frac{c(H^{+})· c(HA^{-})}{c(H_{2}A)}$,知$\frac{c(HA^{-})}{c(H_{2}A)}=10^{2.9}>1$,故$c(HA^{-})>c(H_{2}A)$,由$K_{a2}(H_{2}A)=\frac{c(H^{+})· c(A^{2-})}{c(HA^{-})}$,知$\frac{c(A^{2-})}{c(HA^{-})}=10^{-2.3}<1$,故$c(HA^{-})>c(A^{2-})$,由$K_{a1}(H_{2}A)· K_{a2}(H_{2}A)=\frac{c^{2}(H^{+})· c(A^{2-})}{c(H_{2}A)}$,知$\frac{c(A^{2-})}{c(H_{2}A)}=10^{0.6}>1$,故$c(A^{2-})>c(H_{2}A)$,即溶液中$c(HA^{-})>c(A^{2-})>c(H_{2}A)$,C错误;$pH=6.8$时,联立电荷守恒$c(H^{+})+2c(M^{2+})=c(OH^{-})+c(Cl^{-})+c(HA^{-})+2c(A^{2-})$和元素质量守恒$c(M^{2+})=c(H_{2}A)+c(HA^{-})+c(A^{2-})$,可得质子守恒:$c(H^{+})+2c(H_{2}A)+c(HA^{-})=c(OH^{-})+c(Cl^{-})$,D错误。
3. (2025·黑吉辽蒙卷)室温下,将0.1mol AgCl置于$0.1mol· L^{-1}NH_{4}NO_{3}$溶液中,保持溶液体积和N元素总物质的量不变,pX-pH曲线如图,$Ag^{+}+NH_{3}\rightleftharpoons[Ag(NH_{3})]^{+}$和$Ag^{+}+2NH_{3}\rightleftharpoons[Ag(NH_{3})_{2}]^{+}$的平衡常数分别为$K_{1}$和$K_{2}$;$NH_{4}^{+}$的水解常数$K_{h}(NH_{4}^{+})=10^{-9.25}$。下列说法错误的是(
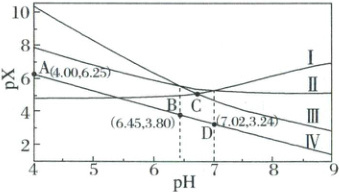
$pX=-lg[c(X)/(mol· L^{-1})]$
X代表$Ag^{+}$、$[Ag(NH_{3})]^{+}$、$[Ag(NH_{3})_{2}]^{+}$或$NH_{3}$
A.Ⅲ为$[Ag(NH_{3})_{2}]^{+}$的变化曲线
B.D点:$c(NH_{4}^{+})-c(OH^{-})>0.1-c(H^{+})$
C.$K_{1}=10^{3.24}$
D.C点:$c(NH_{3})=10^{-3.52}mol· L^{-1}$
B
)
$pX=-lg[c(X)/(mol· L^{-1})]$
X代表$Ag^{+}$、$[Ag(NH_{3})]^{+}$、$[Ag(NH_{3})_{2}]^{+}$或$NH_{3}$
A.Ⅲ为$[Ag(NH_{3})_{2}]^{+}$的变化曲线
B.D点:$c(NH_{4}^{+})-c(OH^{-})>0.1-c(H^{+})$
C.$K_{1}=10^{3.24}$
D.C点:$c(NH_{3})=10^{-3.52}mol· L^{-1}$
答案:
3.B$NH_{4}NO_{3}$溶液中$NH_{4}^{+}$易水解,初始溶液显弱酸性,随着$pH$升高,$NH_{4}^{+}$会转化成$NH_{3}·H_{2}O$、$NH_{3}$,保持溶液体积和$N$元素总物质的量不变,故$c(NH_{3})$增大,则平衡$Ag^{+}+NH_{3}\rightleftharpoons[Ag(NH_{3})]^{+}$、$Ag^{+}+2NH_{3}\rightleftharpoons[Ag(NH_{3})_{2}]^{+}$会向右移动,$c(Ag^{+})$降低,$c\{[Ag(NH_{3})]^{+}\}$、$c\{[Ag(NH_{3})_{2}]^{+}\}$增大,故曲线Ⅰ表示$Ag^{+}$的变化曲线。已知$K_{h}(NH_{4}^{+})=\frac{c(NH_{3}·H_{2}O)· c(H^{+})}{c(NH_{4}^{+})}=10^{-9.25}$,将$pH=4.00$,即$c(H^{+})=10^{-4} mol·L^{-1}$代入可得$\frac{c(NH_{3}·H_{2}O)×10^{-4}}{c(NH_{4}^{+})}=10^{-9.25}$,则$\frac{c(NH_{3}·H_{2}O)}{c(NH_{4}^{+})}=10^{-5.25}$(①),即$c(NH_{3}·H_{2}O)\ll c(NH_{4}^{+})$,根据元素质量守恒可知,$0.1 mol·L^{-1}=c(NH_{3}·H_{2}O)+c(NH_{4}^{+})+c(NH_{3})+c\{[Ag(NH_{3})]^{+}\}+2c\{[Ag(NH_{3})_{2}]^{+}\}$,结合题图可知,$NH_{3}$、$[Ag(NH_{3})]^{+}$、$[Ag(NH_{3})_{2}]^{+}$浓度均小于$10^{-6} mol·L^{-1}$,故可近似得出$0.1 mol·L^{-1}\approx c(NH_{4}^{+})$,代入①式得$c(NH_{3}·H_{2}O)\approx10^{-6.25} mol·L^{-1}$。综上,$pH=4.00$时,$pNH_{3}=6.25$,刚好为A点,则曲线Ⅳ代表$NH_{3}$的变化曲线。由$Ag^{+}+NH_{3}\rightleftharpoons[Ag(NH_{3})]^{+}$、$Ag^{+}+2NH_{3}\rightleftharpoons[Ag(NH_{3})_{2}]^{+}$知,生成$[Ag(NH_{3})_{2}]^{+}$消耗的$NH_{3}$的量比生成$[Ag(NH_{3})]^{+}$多,则$[Ag(NH_{3})_{2}]^{+}$浓度受$c(NH_{3})$变化影响更大(化学计量数越大的物质对平衡影响越大),故曲线Ⅱ、Ⅲ中随$pH$变化幅度较大的曲线Ⅲ代表$[Ag(NH_{3})_{2}]^{+}$的变化曲线,曲线Ⅱ代表$[Ag(NH_{3})]^{+}$的变化曲线。
由上述分析知,A正确;D点对应溶液的$pH>7$,呈弱碱性,说明此时体系中加入了某种碱,则阳离子中还应有其他阳离子$M^{n+}$,该溶液中的电荷守恒式为$c(NH_{4}^{+})+c(H^{+})+c(Ag^{+})+c\{[Ag(NH_{3})]^{+}\}+c\{[Ag(NH_{3})_{2}]^{+}\}+n· c(M^{n+})=c(NO_{3}^{-})+c(OH^{-})+c(Cl^{-})$,由于$Cl^{-}$、$Ag^{+}$、$[Ag(NH_{3})]^{+}$、$[Ag(NH_{3})_{2}]^{+}$均来自$AgCl$,故$n(Ag):n(Cl)=1:1$,存在元素质量守恒:$c(Ag^{+})+c\{[Ag(NH_{3})]^{+}\}+c\{[Ag(NH_{3})_{2}]^{+}\}=c(Cl^{-})$,两式联立得$c(NH_{4}^{+})+c(H^{+})+n· c(M^{n+})=c(NO_{3}^{-})+c(OH^{-})$,则$c(NH_{4}^{+})+c(H^{+})<c(NO_{3}^{-})+c(OH^{-})$,即$c(NH_{4}^{+})-c(OH^{-})<0.1-c(H^{+})$,B错误;曲线Ⅰ、Ⅱ对应的交点处有$c(Ag^{+})=c\{[Ag(NH_{3})]^{+}\}$,且对应的$pH$为$7.02$,$c(NH_{3})=10^{-3.24} mol·L^{-1}$,代入得$K_{1}=\frac{c\{[Ag(NH_{3})]^{+}\}}{c(Ag^{+})· c(NH_{3})}=\frac{1}{c(NH_{3})}=10^{3.24}$,C正确;曲线Ⅱ、Ⅲ对应的交点处有$c\{[Ag(NH_{3})]^{+}\}=c\{[Ag(NH_{3})_{2}]^{+}\}$,则$[Ag(NH_{3})]^{+}+NH_{3}\rightleftharpoons[Ag(NH_{3})_{2}]^{+}$的平衡常数$K_{3}=\frac{c\{[Ag(NH_{3})_{2}]^{+}\}}{c\{[Ag(NH_{3})]^{+}\}· c(NH_{3})}=\frac{1}{c(NH_{3})}=10^{3.80}$,$K_{2}=K_{1}· K_{3}=10^{3.24}×10^{3.80}=10^{7.04}$,C点为曲线Ⅰ、Ⅲ的交点,$c(Ag^{+})=c\{[Ag(NH_{3})_{2}]^{+}\}$,代入得$K_{2}=\frac{c\{[Ag(NH_{3})_{2}]^{+}\}}{c(Ag^{+})· c^{2}(NH_{3})}=\frac{1}{c^{2}(NH_{3})}=10^{7.04}$,则此时$c(NH_{3})=10^{-3.52} mol·L^{-1}$,D正确。
由上述分析知,A正确;D点对应溶液的$pH>7$,呈弱碱性,说明此时体系中加入了某种碱,则阳离子中还应有其他阳离子$M^{n+}$,该溶液中的电荷守恒式为$c(NH_{4}^{+})+c(H^{+})+c(Ag^{+})+c\{[Ag(NH_{3})]^{+}\}+c\{[Ag(NH_{3})_{2}]^{+}\}+n· c(M^{n+})=c(NO_{3}^{-})+c(OH^{-})+c(Cl^{-})$,由于$Cl^{-}$、$Ag^{+}$、$[Ag(NH_{3})]^{+}$、$[Ag(NH_{3})_{2}]^{+}$均来自$AgCl$,故$n(Ag):n(Cl)=1:1$,存在元素质量守恒:$c(Ag^{+})+c\{[Ag(NH_{3})]^{+}\}+c\{[Ag(NH_{3})_{2}]^{+}\}=c(Cl^{-})$,两式联立得$c(NH_{4}^{+})+c(H^{+})+n· c(M^{n+})=c(NO_{3}^{-})+c(OH^{-})$,则$c(NH_{4}^{+})+c(H^{+})<c(NO_{3}^{-})+c(OH^{-})$,即$c(NH_{4}^{+})-c(OH^{-})<0.1-c(H^{+})$,B错误;曲线Ⅰ、Ⅱ对应的交点处有$c(Ag^{+})=c\{[Ag(NH_{3})]^{+}\}$,且对应的$pH$为$7.02$,$c(NH_{3})=10^{-3.24} mol·L^{-1}$,代入得$K_{1}=\frac{c\{[Ag(NH_{3})]^{+}\}}{c(Ag^{+})· c(NH_{3})}=\frac{1}{c(NH_{3})}=10^{3.24}$,C正确;曲线Ⅱ、Ⅲ对应的交点处有$c\{[Ag(NH_{3})]^{+}\}=c\{[Ag(NH_{3})_{2}]^{+}\}$,则$[Ag(NH_{3})]^{+}+NH_{3}\rightleftharpoons[Ag(NH_{3})_{2}]^{+}$的平衡常数$K_{3}=\frac{c\{[Ag(NH_{3})_{2}]^{+}\}}{c\{[Ag(NH_{3})]^{+}\}· c(NH_{3})}=\frac{1}{c(NH_{3})}=10^{3.80}$,$K_{2}=K_{1}· K_{3}=10^{3.24}×10^{3.80}=10^{7.04}$,C点为曲线Ⅰ、Ⅲ的交点,$c(Ag^{+})=c\{[Ag(NH_{3})_{2}]^{+}\}$,代入得$K_{2}=\frac{c\{[Ag(NH_{3})_{2}]^{+}\}}{c(Ag^{+})· c^{2}(NH_{3})}=\frac{1}{c^{2}(NH_{3})}=10^{7.04}$,则此时$c(NH_{3})=10^{-3.52} mol·L^{-1}$,D正确。
4. (2024·河北卷)在水溶液中,$CN^{-}$可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与$CN^{-}$形成配离子达平衡时,$lg\frac{c(金属离子)}{c(配离子)}$与$-lgc(CN^{-})$的关系如图。
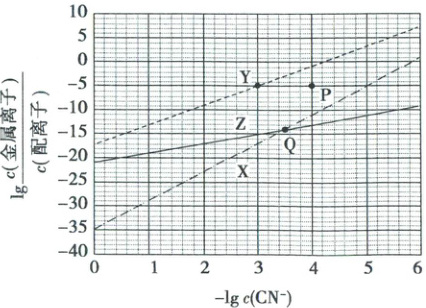
下列说法正确的是(
A.99%的X、Y转化为配离子时,两溶液中$CN^{-}$的平衡浓度X>Y
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时$\frac{c(X)}{c(X配离子)}>\frac{c(Z)}{c(Z配离子)}$
C.由Y和Z分别制备等物质的量的配离子时,消耗$CN^{-}$的物质的量Y<Z
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率

下列说法正确的是(
B
)A.99%的X、Y转化为配离子时,两溶液中$CN^{-}$的平衡浓度X>Y
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时$\frac{c(X)}{c(X配离子)}>\frac{c(Z)}{c(Z配离子)}$
C.由Y和Z分别制备等物质的量的配离子时,消耗$CN^{-}$的物质的量Y<Z
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
答案:
4.B设X的初始浓度为$a$,$99\%$的X转化成配离子时,$c(X)=0.01a$,$c[X(CN)_{x}]=0.99a$,$\lg\frac{c(X)}{c[X(CN)_{x}]}=\lg\frac{0.01a}{0.99a}\approx-2$,同理,$\lg\frac{c(Y)}{c[Y(CN)_{y}]}\approx-2$,在图像中找到X、Y两直线纵坐标值为$-2$对应的横坐标的值,X的横坐标数值更大,由于横坐标是$-\lg c(CN^{-})$,则X对应的$c(CN^{-})$更小,A错误;向Q点X、Z的混合液中加少量可溶性Y盐,Y会消耗溶液中的$CN^{-}$,新平衡下$c(CN^{-})$会变小,$-\lg c(CN^{-})$就会变大,则此时X、Z对应的点会沿着相应直线向右移动,结合图像可知,移动后$\lg\frac{c(X)}{c[X(CN)_{x}]}>\lg\frac{c(Z)}{c[Z(CN)_{x}]}$,则$\frac{c(X)}{c[X(CN)_{x}]}>\frac{c(Z)}{c[Z(CN)_{x}]}$,B正确;根据上述分析知,$x>y>z$,因此由Y和Z分别制备等物质的量的配离子时,消耗$CN^{-}$的物质的量$Y>Z$,C错误;直线上的点代表平衡状态,P点在Y对应直线的下方,在$-\lg c(CN^{-})$不变,即$c(CN^{-})$不变的情况下,P点的$\lg\frac{c(Y)}{c[Y(CN)_{y}]}$相比平衡时偏小,即$\frac{c(Y)}{c[Y(CN)_{y}]}$偏小,则此时$Q_{Y}=\frac{c(Y)· c^{y}(CN^{-})}{c[Y(CN)_{y}]}<K_{Y}$,则解离平衡$Y(CN)_{y}\rightleftharpoonsY+yCN^{-}$会向右移动,故P点时Y配离子的解离速率大于生成速率,D错误。
查看更多完整答案,请扫码查看


