2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
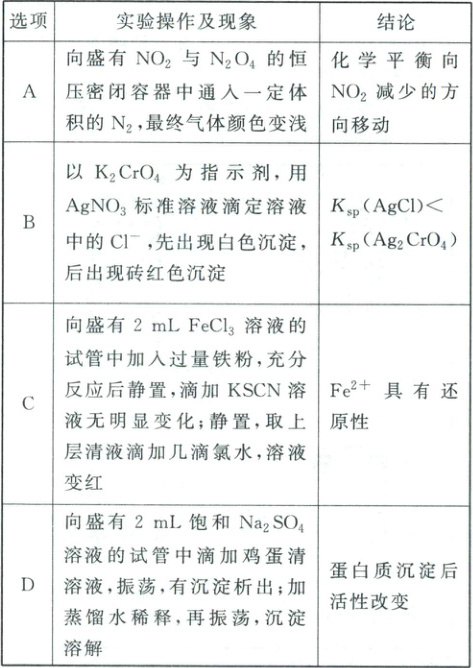
3. (2025·河北卷)下列实验操作及现象能得出相应结论的是(
C
)
答案:
3.C 恒压密闭容器中通入$N_2$、$NO_2$、$N_2O_4$浓度减小,故混合体系颜色变浅,同时反应物、生成物分压均减小,相当于减小压强,平衡向气体分子数增大的方向移动,即向$NO_2$增加的方向移动,A不符合题意;$AgCl$和$Ag_2CrO_4$类型不同,$K_{sp}(AgCl)$与$K_{sp}(Ag_2CrO_4)$的表达式不同,无法根据沉淀出现的先后顺序判断两者大小关系,B不符合题意;$FeCl_3$溶液中加入过量铁粉,静置后滴加$KSCN$溶液无明显变化,说明此时所得溶液中$Fe$元素以$Fe^{2+}$形式存在,取上层清液滴加几滴氯水后,溶液变红,说明$Fe^{2+}$被氧化为$Fe^{3+}$,$Fe^{2+}$体现还原性,C符合题意;鸡蛋清溶液遇饱和$Na_2SO_4$溶液发生盐析,加水稀释后恢复,不改变蛋白质的活性,D不符合题意。
4. (2025·河南卷)某同学设计以下实验,探究简单配合物的形成和转化。
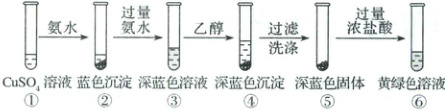
下列说法错误的是(
A.②中沉淀与④中沉淀不是同一种物质
B.③中现象说明配体与$Cu^{2+}$的结合能力:$NH_{3}\gtH_{2}O$
C.④中深蓝色物质在乙醇中的溶解度比在水中小
D.若向⑤中加入稀硫酸,同样可以得到黄绿色溶液

下列说法错误的是(
D
)A.②中沉淀与④中沉淀不是同一种物质
B.③中现象说明配体与$Cu^{2+}$的结合能力:$NH_{3}\gtH_{2}O$
C.④中深蓝色物质在乙醇中的溶解度比在水中小
D.若向⑤中加入稀硫酸,同样可以得到黄绿色溶液
答案:
4.D 向$CuSO_4$溶液中加入氨水生成蓝色$Cu(OH)_2$沉淀,继续滴加过量氨水,$Cu(OH)_2$沉淀转化为$[Cu(NH_3)_4]SO_4$深蓝色溶液,再加入乙醇,可以降低$[Cu(NH_3)_4]SO_4$的溶解度,使$[Cu(NH_3)_4]SO_4$析出,过滤后洗涤可得到$[Cu(NH_3)_4]SO_4$深蓝色固体,向$[Cu(NH_3)_4]SO_4$固体中加入过量浓盐酸,$[Cu(NH_3)_4]SO_4$固体溶解,转化为$[CuCl_4]^{2-}$黄绿色溶液。
由上述分析知,②中沉淀为$Cu(OH)_2$,④中沉淀为$[Cu(NH_3)_4]SO_4$,二者不是同一种物质,A正确;③中现象说明向$CuSO_4$溶液中(含有$[Cu(H_2O)_4]SO_4$)加入过量氨水,$[Cu(H_2O)_4]SO_4$可以转化为$[Cu(NH_3)_4]SO_4$,说明配体与$Cu^{2+}$的结合能力:$NH_3>H_2O$,B正确;向$[Cu(NH_3)_4]SO_4$深蓝色溶液中加入乙醇,可以降低$[Cu(NH_3)_4]SO_4$的溶解度,使$[Cu(NH_3)_4]SO_4$析出,即④中深蓝色物质在乙醇中的溶解度比在水中的小,C正确;向⑤中深蓝色固体中加入过量浓盐酸,$[Cu(NH_3)_4]SO_4$固体溶解,转化为$[CuCl_4]^{2-}$黄绿色溶液,若改为向⑤中加入稀硫酸,$[Cu(NH_3)_4]SO_4$中的$NH_3$与$H^+$反应生成$NH_4^+$,其反应为$[Cu(NH_3)_4]^{2+}+4H^+\longrightarrowCu^{2+}+4NH_4^+$,最后得到$CuSO_4$蓝色溶液,不能得到黄绿色溶液,D错误。
由上述分析知,②中沉淀为$Cu(OH)_2$,④中沉淀为$[Cu(NH_3)_4]SO_4$,二者不是同一种物质,A正确;③中现象说明向$CuSO_4$溶液中(含有$[Cu(H_2O)_4]SO_4$)加入过量氨水,$[Cu(H_2O)_4]SO_4$可以转化为$[Cu(NH_3)_4]SO_4$,说明配体与$Cu^{2+}$的结合能力:$NH_3>H_2O$,B正确;向$[Cu(NH_3)_4]SO_4$深蓝色溶液中加入乙醇,可以降低$[Cu(NH_3)_4]SO_4$的溶解度,使$[Cu(NH_3)_4]SO_4$析出,即④中深蓝色物质在乙醇中的溶解度比在水中的小,C正确;向⑤中深蓝色固体中加入过量浓盐酸,$[Cu(NH_3)_4]SO_4$固体溶解,转化为$[CuCl_4]^{2-}$黄绿色溶液,若改为向⑤中加入稀硫酸,$[Cu(NH_3)_4]SO_4$中的$NH_3$与$H^+$反应生成$NH_4^+$,其反应为$[Cu(NH_3)_4]^{2+}+4H^+\longrightarrowCu^{2+}+4NH_4^+$,最后得到$CuSO_4$蓝色溶液,不能得到黄绿色溶液,D错误。
5. (2025·黑吉辽蒙卷)化学需氧量($COD$)是衡量水体中有机物污染程度的指标之一,以水样消耗氧化剂的量折算成消耗$O_{2}$的量(单位为$mg·L^{-1}$)来表示。碱性$KMnO_{4}$不与$Cl^{-}$反应,可用于测定含$Cl^{-}$水样的$COD$,流程如图。
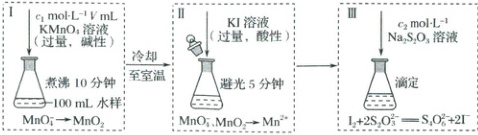
下列说法错误的是(
A.Ⅱ中发生的反应有$MnO_{2}+2I^{-}+4H^{+}=Mn^{2+}+I_{2}+2H_{2}O$
B.Ⅱ中避光、加盖可抑制$I^{-}$被$O_{2}$氧化及$I_{2}$的挥发
C.Ⅲ中消耗的$Na_{2}S_{2}O_{3}$越多,水样的$COD$值越高
D.若Ⅰ中为酸性条件,测得含$Cl^{-}$水样的$COD$值偏高

下列说法错误的是(
C
)A.Ⅱ中发生的反应有$MnO_{2}+2I^{-}+4H^{+}=Mn^{2+}+I_{2}+2H_{2}O$
B.Ⅱ中避光、加盖可抑制$I^{-}$被$O_{2}$氧化及$I_{2}$的挥发
C.Ⅲ中消耗的$Na_{2}S_{2}O_{3}$越多,水样的$COD$值越高
D.若Ⅰ中为酸性条件,测得含$Cl^{-}$水样的$COD$值偏高
答案:
5.C 由图中装置Ⅱ中的信息可知,$MnO_4^-$、$MnO_2$在酸性条件下被$I^-$还原为$Mn^{2+}$,由得失电子守恒、原子守恒及电荷守恒可知,A正确;若装置Ⅱ不加盖,则空气可进入该装置氧化$I^-$,且光照会加快碘单质的挥发,故B正确;装置Ⅲ消耗的$Na_2S_2O_3$越多,说明装置Ⅱ中生成的$I_2$越多,则Ⅰ中消耗的$MnO_4^-$越少,故水样的COD值越低,C错误;若装置Ⅰ的体系为酸性环境,则$MnO_4^-$被$Cl^-$还原为$Mn^{2+}$,水样消耗的$MnO_4^-$偏多,故Ⅱ中生成的$I_2$偏少,Ⅲ中消耗的$Na_2S_2O_3$偏少,测得的含$Cl^-$水样的COD值偏高,D正确。
6. (2025·北京卷)为研究三价铁配合物性质进行如下实验(忽略溶液体积变化)。
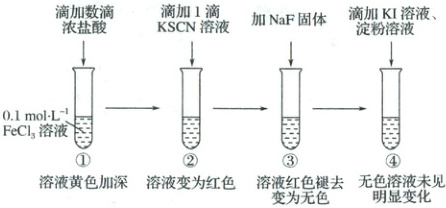
已知:$[FeCl_{4}]^{-}$为黄色、$[Fe(SCN)]^{2+}$为红色、$[FeF_{6}]^{3-}$为无色。
下列说法
A.①中浓盐酸促进$Fe^{3+}+4Cl^{-}\rightleftharpoons[FeCl_{4}]^{-}$平衡正向移动
B.由①到②,生成$[Fe(SCN)]^{2+}$并消耗$[FeCl_{4}]^{-}$
C.②、③对比,说明$c(Fe^{3+})$:②$\gt$③
D.由①$\to$④推断,若向①深黄色溶液中加入$KI$、淀粉溶液,溶液也无明显变化

已知:$[FeCl_{4}]^{-}$为黄色、$[Fe(SCN)]^{2+}$为红色、$[FeF_{6}]^{3-}$为无色。
下列说法
不
正
确
的是(D
)A.①中浓盐酸促进$Fe^{3+}+4Cl^{-}\rightleftharpoons[FeCl_{4}]^{-}$平衡正向移动
B.由①到②,生成$[Fe(SCN)]^{2+}$并消耗$[FeCl_{4}]^{-}$
C.②、③对比,说明$c(Fe^{3+})$:②$\gt$③
D.由①$\to$④推断,若向①深黄色溶液中加入$KI$、淀粉溶液,溶液也无明显变化
答案:
6.D $0.1\ mol·L^{-1}$的$FeCl_3$溶液滴加数滴浓盐酸,生成更多的$[FeCl_4]^-$,溶液黄色加深;继续滴加1滴$KSCN$溶液,$[FeCl_4]^-$转化为$[Fe(SCN)]^{2+}$,溶液变为红色;再加入$NaF$固体,$[Fe(SCN)]^{2+}$转化为$[FeF_6]^{3-}$,溶液红色褪去,变为无色;再滴加$KI$溶液、淀粉溶液,无色溶液未见明显变化,说明$I^-$未被氧化。①中滴加数滴浓盐酸,试管溶液黄色加深,生成更多的$[FeCl_4]^-$,说明浓盐酸促进$Fe^{3+}+4Cl^-\rightleftharpoons[FeCl_4]^-$平衡正向移动,A正确;由①到②,溶液变为红色,说明$[FeCl_4]^-$转化为$[Fe(SCN)]^{2+}$,即生成$[Fe(SCN)]^{2+}$并消耗$[FeCl_4]^-$,B正确;②、③溶液中,均存在平衡$Fe^{3+}+SCN^-\rightleftharpoons[Fe(SCN)]^{2+}$,由于温度不变,故该反应的平衡常数不变,由于②、③溶液中含有的初始$SCN^-$浓度相同,且②溶液为红色,③溶液为无色,故能说明$c(Fe^{3+})$:②>③,C正确;类似C选项分析,配离子$[FeCl_4]^-$的稳定性最小,①中$c(Fe^{3+})$最大,可以氧化$I^-$,生成$I_2$,$I_2$遇到淀粉显蓝色,D错误;故选D。
查看更多完整答案,请扫码查看


