2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2025·陕西省十七校联考高三试题)室温下,向$10\ mL\ 0.1\ mol·L^{-1}\ {NaCl}$溶液和$10\ mL\ 0.1\ mol·L^{-1}\ {Na_{2}SO_{4}}$溶液中分别滴入$0.1\ mol·L^{-1}\ {AgNO_{3}}$溶液至恰好完全反应,溶液的$pM$[$pM = -\lg c$或$-\lg c({SO^{2-}_{4}})$]与滴入的${AgNO_{3}}$溶液的体积的关系如图所示。下列说法正确的是(
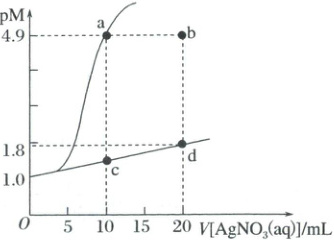
A.室温下,$K_{sp}({AgCl}) = 1.0×10^{-9.6}$
B.a、c、d点对应溶液中,$c({Ag^{+}})$最大的是c点
C.若用$0.05\ mol·L^{-1}\ {AgNO_{3}}$溶液滴定,则a点向b点移动
D.室温下,反应${Ag_{2}SO_{4}(s) + 2Cl^{-}(aq)⇌ 2AgCl(s) + SO^{2-}_{4}(aq)}$的平衡常数$K = 2.0×10^{14.2}$
C
)
A.室温下,$K_{sp}({AgCl}) = 1.0×10^{-9.6}$
B.a、c、d点对应溶液中,$c({Ag^{+}})$最大的是c点
C.若用$0.05\ mol·L^{-1}\ {AgNO_{3}}$溶液滴定,则a点向b点移动
D.室温下,反应${Ag_{2}SO_{4}(s) + 2Cl^{-}(aq)⇌ 2AgCl(s) + SO^{2-}_{4}(aq)}$的平衡常数$K = 2.0×10^{14.2}$
答案:
3.C A项,根据离子反应$Ag^++Cl^-\rightleftharpoons AgCl\downarrow$和$Ag^++\frac{1}{2}SO_4^{2-}\rightleftharpoons\frac{1}{2}Ag_2SO_4\downarrow$可知,滴入相同体积的$AgNO_3$溶液,消耗的$Cl^-$的物质的量更多,则剩余的$Cl^-$的物质的量更少,因为$Cl^-$和$SO_4^{2-}$的物质的量浓度相同,故剩余的$Cl^-$的pM值更大,故a点所在曲线代表$-lgc(Cl^-)$与滴入的$AgNO_3$溶液的体积的关系,a点对应溶液中$c(Cl^-)=1.0×10^{-4.9}mol· L^{-1}$,室温下,$K_{sp}(AgCl)=1.0×10^{-4.9}×1.0×10^{-4.9}=1.0×10^{-9.8}$,A错误;B项,滴入20mL0.1mol·L^{-1}AgNO_3溶液,10mL0.1mol·L^{-1}Na_2SO_4溶液恰好完全反应,根据图像可知,d点所在曲线代表$-lgc(SO_4^{2-})$与滴入的$AgNO_3$溶液的体积的关系,d点对应溶液中$c(SO_4^{2-})=1.0×10^{-1.8}mol· L^{-1}$,则溶液中$c(Ag^+)=2.0×10^{-1.8}mol· L^{-1}$,室温下,$K_{sp}(Ag_2SO_4)=(2.0×10^{-1.8})^2×1.0×10^{-1.8}=4.0×10^{-5.4}$。a点对应溶液中的$c(Ag^+)=1.0×10^{-4.9}mol· L^{-1}$,d点对应溶液中的$c(Ag^+)=2.0×10^{-1.8}mol· L^{-1}$,c点对应溶液中$Na_2SO_4$还剩余一半,c点对应溶液中的$c(SO_4^{2-})$大于d点对应溶液中的$c(SO_4^{2-})$,c、d两点温度相同(均为室温下),$K_{sp}(Ag_2SO_4)$相同,则c点对应溶液中的$c(Ag^+)$小于d点对应溶液中的$c(Ag^+)$,故a、c、d点对应溶液中,$c(Ag^+)$最大的是
d点,B错误;C项,a点所在曲线代表$-lgc(Cl^-)$与滴入的$AgNO_3$溶液的体积的关系,若用$0.05mol· L^{-1}AgNO_3$溶液滴定10mL0.1mol·L^{-1}NaCl溶液,当滴入的$V[AgNO_3(aq)]=20mL$时,NaCl和$AgNO_3$恰好完全反应,由于温度不变,则$K_{sp}(AgCl)$不变,此时溶液中$c(Cl^-)=1.0×10^{-4.9}mol· L^{-1}$,则图中a点向b点移动,C正确;D项,室温下,反应$Ag_2SO_4(s)+2Cl^-(aq)\rightleftharpoons2AgCl(s)+SO_4^{2-}(aq)$的平衡常数$K=\frac{c(SO_4^{2-})}{c^2(Cl^-)}=\frac{c^2(Ag^+)· c(SO_4^{2-})}{c^2(Ag^+)· c^2(Cl^-)}=\frac{K_{sp}(Ag_2SO_4)}{K^2_{sp}(AgCl)}=\frac{4.0×10^{-5.4}}{(1.0×10^{-9.8})^2}=4.0×10^{14.2}$,D错误;故选C。
d点,B错误;C项,a点所在曲线代表$-lgc(Cl^-)$与滴入的$AgNO_3$溶液的体积的关系,若用$0.05mol· L^{-1}AgNO_3$溶液滴定10mL0.1mol·L^{-1}NaCl溶液,当滴入的$V[AgNO_3(aq)]=20mL$时,NaCl和$AgNO_3$恰好完全反应,由于温度不变,则$K_{sp}(AgCl)$不变,此时溶液中$c(Cl^-)=1.0×10^{-4.9}mol· L^{-1}$,则图中a点向b点移动,C正确;D项,室温下,反应$Ag_2SO_4(s)+2Cl^-(aq)\rightleftharpoons2AgCl(s)+SO_4^{2-}(aq)$的平衡常数$K=\frac{c(SO_4^{2-})}{c^2(Cl^-)}=\frac{c^2(Ag^+)· c(SO_4^{2-})}{c^2(Ag^+)· c^2(Cl^-)}=\frac{K_{sp}(Ag_2SO_4)}{K^2_{sp}(AgCl)}=\frac{4.0×10^{-5.4}}{(1.0×10^{-9.8})^2}=4.0×10^{14.2}$,D错误;故选C。
1. (2025·甘肃卷)氨基乙酸(${NH_{2}CH_{2}COOH}$)是结构最简单的氨基酸分子,其分子在水溶液中存在如下平衡:
${^{+}NH_{3}CH_{2}COOH \xrightleftharpoons{pK_{1}=2.4} ^{+}NH_{3}CH_{2}COO^{-} \xrightleftharpoons{pK_{2}=9.6} NH_{2}CH_{2}COO^{-}}$
在$25^{\circ}C$时,其分布分数$\delta$[如$\delta({NH_{2}CH_{2}COO^{-}})=\frac{c({NH_{2}CH_{2}COO^{-}})}{c({^{+}NH_{3}CH_{2}COOH}) + c({^{+}NH_{3}CH_{2}COO^{-}}) + c({NH_{2}CH_{2}COO^{-}})}$]与溶液$pH$关系如图1所示。在$100\ mL\ 0.01\ mol· L^{-1}{^{+}NH_{3}CH_{2}COOH· Cl^{-}}$溶液中逐滴滴入$0.1\ mol· L^{-1}\ NaOH$溶液,溶液$pH$与$NaOH$溶液滴入体积的变化关系如图2所示。下列说法错误的是(
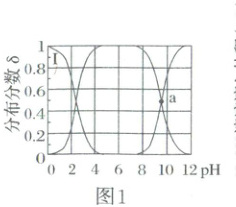
A.曲线Ⅰ对应的离子是${^{+}NH_{3}CH_{2}COOH}$
B.a点处对应的$pH$为$9.6$
C.b点处$c({^{+}NH_{3}CH_{2}COOH}) = c({NH_{2}CH_{2}COO^{-}})$
D.c点处$2c({^{+}NH_{3}CH_{2}COOH}) + c({^{+}NH_{3}CH_{2}COO^{-}}) + c({H^{+}}) = c({OH^{-}})$
${^{+}NH_{3}CH_{2}COOH \xrightleftharpoons{pK_{1}=2.4} ^{+}NH_{3}CH_{2}COO^{-} \xrightleftharpoons{pK_{2}=9.6} NH_{2}CH_{2}COO^{-}}$
在$25^{\circ}C$时,其分布分数$\delta$[如$\delta({NH_{2}CH_{2}COO^{-}})=\frac{c({NH_{2}CH_{2}COO^{-}})}{c({^{+}NH_{3}CH_{2}COOH}) + c({^{+}NH_{3}CH_{2}COO^{-}}) + c({NH_{2}CH_{2}COO^{-}})}$]与溶液$pH$关系如图1所示。在$100\ mL\ 0.01\ mol· L^{-1}{^{+}NH_{3}CH_{2}COOH· Cl^{-}}$溶液中逐滴滴入$0.1\ mol· L^{-1}\ NaOH$溶液,溶液$pH$与$NaOH$溶液滴入体积的变化关系如图2所示。下列说法错误的是(
C
)
A.曲线Ⅰ对应的离子是${^{+}NH_{3}CH_{2}COOH}$
B.a点处对应的$pH$为$9.6$
C.b点处$c({^{+}NH_{3}CH_{2}COOH}) = c({NH_{2}CH_{2}COO^{-}})$
D.c点处$2c({^{+}NH_{3}CH_{2}COOH}) + c({^{+}NH_{3}CH_{2}COO^{-}}) + c({H^{+}}) = c({OH^{-}})$

答案:
1.C 曲线Ⅰ对应物质的分布分数随pH增大逐渐减小,pH=0时,溶液呈强酸性,故曲线Ⅰ对应的离子为$^+NH_3CH_2COOH$,A 正确;a 点时$c(^+NH_3CH_2COO^-) = c(NH_3CH_2COO^-)$,$K_2=\frac{c(^+H)· c(NH_3CH_2COO^-) }{c(^+NH_3CH_2COO^-)} =c(^+H)=10^{-9.6}$,故此时pH=9.6,B正确;b点对应溶液pH=6,滴入10 mL NaOH溶液,该点溶液中存在电荷守恒:$c(^+H)+c(Na^+)+c(^+NH_3CH_2COOH)=c(OH^-)+c(Cl^-)+c(NH_2CH_2COO^-)$,而$c(^+H)>c(OH^-)$、$c(Na^+)=c(Cl^-)$,故$c(^+NH_3CH_2COOH)<c(NH_2CH_2COO^-)$,C错误;c点加入20 mLNaOH溶液,所得溶液中溶质为$NH_2CH_2COONa$,结合质子守恒可知,$2c(^+NH_3CH_2COOH)+c(^+NH_3CH_2COO^-)+c(^+H)=c(OH^-)$,D正确。
2. (2025·湖北卷)铜(Ⅰ)、乙腈(简写为$L$)的某水溶液体系中含铜物种的分布曲线如图。纵坐标($\delta$)为含铜物种占总铜的物质的量分数,总铜浓度为$1.0×10^{-3}\ mol· L^{-1}$。下列描述正确的是(
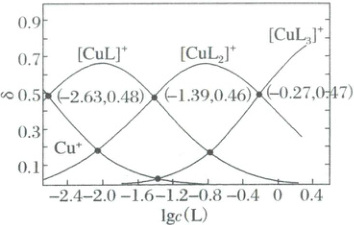
A.${Cu^{+} + 3L \rightleftharpoons [CuL_{3}]^{+}}$的$\lg K = 0.27$
B.当$c({Cu^{+}}) = c\{[{CuL}]^{+}\}$时,$c\{[{CuL_{2}}]^{+}\} = 2.0×10^{-4}\ mol· L^{-1}$
C.$n$从$0$增加到$2$,$[{CuL_{n}}]^{+}$结合$L$的能力随之减小
D.若$c\{[{CuL}]^{+}\} = c\{[{CuL_{3}}]^{+}\}$,则$2c\{[{CuL_{2}}]^{+}\} \lt c\{[{CuL}]^{+}\} + 3c\{[{CuL_{3}}]^{+}\}$
C
)
A.${Cu^{+} + 3L \rightleftharpoons [CuL_{3}]^{+}}$的$\lg K = 0.27$
B.当$c({Cu^{+}}) = c\{[{CuL}]^{+}\}$时,$c\{[{CuL_{2}}]^{+}\} = 2.0×10^{-4}\ mol· L^{-1}$
C.$n$从$0$增加到$2$,$[{CuL_{n}}]^{+}$结合$L$的能力随之减小
D.若$c\{[{CuL}]^{+}\} = c\{[{CuL_{3}}]^{+}\}$,则$2c\{[{CuL_{2}}]^{+}\} \lt c\{[{CuL}]^{+}\} + 3c\{[{CuL_{3}}]^{+}\}$
答案:
2.C $Cu^+ +3L\rightleftharpoons[CuL_3]^+$的$K=\frac{c\{[CuL_3]^+\}}{c(Cu^+)· c^3(L)}$,当图中$\delta\{[CuL_3]^+\}=\delta(Cu^+)$时,$K=\frac{1}{c^3(L)}$=$-3lgc(L)$,由图像可知,此时$-1.6<lgc(L)<-1.2$,则$lg K\neq0.27$,A错误;当$c(Cu^+)=c\{[CuL]^+\}$时,由图像可知,$\delta(Cu^+)=\delta\{[CuL_3]^+\}=0.48$,$\delta\{[CuL_3]^+\}$可忽略不计,则$\delta\{[CuL_2]^+\}=0.04$,$c\{[CuL_2]^+\}=0.04×1.0×10^{-3}=4×10^{-5}mol/L$,B错误;$[CuL_n]^+$结合L的离子方程式为$[CuL_n]^++L\rightleftharpoons[CuL_{n+1}]^+$,当$\delta\{[CuL_n]^+\}=\delta\{[CuL_{n+1}]^+\}$时,$K=\frac{1}{c(L)}$,由图像交点可知,随着n变大,c(L)逐渐变大,则K值变小,说明$[CuL_n]^+$结合L的能力随之减小,C正确;若$c\{[CuL]^+\}=c\{[CuL_3]^+\}$,由图像交点可知,$\delta\{[CuL]^+\}=\delta\{[CuL_3]^+\}<0.2$,$\delta\{[CuL_2]^+\}>0.6$,则$c\{[CuL_2]^+\}>\{[CuL]^+\}+3c\{[CuL_3]^+\}$,D错误;故选C。
![img alt=图片编号2-1]
![img alt=图片编号2-1]
查看更多完整答案,请扫码查看


