2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·云南卷) $ N_A $ 为阿伏加德罗常数的值。下列说法正确的是
A.$ 22.4\ L\ CH_4 $ 中原子的数目为 $ 5N_A $
B.$ 1\ mol^{18}O $ 所含中子的数目为 $ 10N_A $
C.$ 28\ g\ Fe $ 粉和足量 $ S $ 完全反应,转移电子的数目为 $ 1.5N_A $
D.$ 0.1\ L\ 12\ mol·L^{-1} $ 盐酸与足量 $ MnO_2 $ 反应,生成 $ Cl_2 $ 的数目为 $ 0.3N_A $
A.$ 22.4\ L\ CH_4 $ 中原子的数目为 $ 5N_A $
B.$ 1\ mol^{18}O $ 所含中子的数目为 $ 10N_A $
C.$ 28\ g\ Fe $ 粉和足量 $ S $ 完全反应,转移电子的数目为 $ 1.5N_A $
D.$ 0.1\ L\ 12\ mol·L^{-1} $ 盐酸与足量 $ MnO_2 $ 反应,生成 $ Cl_2 $ 的数目为 $ 0.3N_A $
答案:
1.B 未指明气体是否处于标准状况,22.4LCH₄的物质的量无法确定是否为1mol,因此原子数目无法确定为5Nₐ,A错误;¹⁸O的中子数为18 - 8 = 10,1mol¹⁸O含10mol中子,数目为10Nₐ,B正确;28gFe(0.5mol)与S反应生成FeS,Fe的氧化态为+2,转移电子数为0.5×2 = 1mol = Nₐ,而非1.5Nₐ,C错误;浓盐酸与MnO₂反应时,随反应进行盐酸浓度降低,反应停止,实际生成Cl₂的物质的量小于理论值0.3mol,D错误;故选B。
1.B 未指明气体是否处于标准状况,22.4LCH₄的物质的量无法确定是否为1mol,因此原子数目无法确定为5Nₐ,A错误;¹⁸O的中子数为18 - 8 = 10,1mol¹⁸O含10mol中子,数目为10Nₐ,B正确;28gFe(0.5mol)与S反应生成FeS,Fe的氧化态为+2,转移电子数为0.5×2 = 1mol = Nₐ,而非1.5Nₐ,C错误;浓盐酸与MnO₂反应时,随反应进行盐酸浓度降低,反应停止,实际生成Cl₂的物质的量小于理论值0.3mol,D错误;故选B。

2. (2025·广东卷)设 $ N_A $ 为阿伏加德罗常数的值。下列说法正确的是(
A.$ 1\ mol^{18}O_2 $ 的中子数,比 $ 1\ mol^{16}O_2 $ 的多 $ 2N_A $
B.$ 1\ mol\ Fe $ 与水蒸气完全反应,生成 $ H_2 $ 的数目为 $ 2N_A $
C.在 $ 1\ L\ 0.1\ mol·L^{-1} $ 的 $ NH_4Cl $ 溶液中, $ NH_4^+ $ 的数目为 $ 0.1N_A $
D.标准状况下的 $ 22.4\ L\ Cl_2 $ 与足量 $ H_2 $ 反应,形成的共价键数目为 $ 2N_A $
D
)A.$ 1\ mol^{18}O_2 $ 的中子数,比 $ 1\ mol^{16}O_2 $ 的多 $ 2N_A $
B.$ 1\ mol\ Fe $ 与水蒸气完全反应,生成 $ H_2 $ 的数目为 $ 2N_A $
C.在 $ 1\ L\ 0.1\ mol·L^{-1} $ 的 $ NH_4Cl $ 溶液中, $ NH_4^+ $ 的数目为 $ 0.1N_A $
D.标准状况下的 $ 22.4\ L\ Cl_2 $ 与足量 $ H_2 $ 反应,形成的共价键数目为 $ 2N_A $
答案:
2.D Cl₂和H₂发生反应:Cl₂+H₂=2HCl,标准状况下22.4L(1mol)Cl₂与足量H₂反应,形成的共价键数目为2Nₐ,D正确;1分子¹⁸O₂含有的中子数为20,1分子¹⁶O₂含有的中子数为16,故1mol¹⁸O₂的中子数比1mol¹⁶O₂的多4Nₐ,A错误;Fe与水蒸气发生反应:3Fe + 4H₂O(g)$\stackrel{高温}{=\!=\!=}$Fe₃O₄ + 4H₂,则1molFe与水蒸气完全反应,生成H₂的数目为$\frac{4}{3}$Nₐ,B错误;在1L0.1mol·L⁻¹的NH₄Cl溶液中,由于NH₄⁺会发生水解,故NH₄⁺的数目小于0.1Nₐ,C错误。
3. (2025·河北卷)设 $ N_A $ 是阿伏加德罗常数的值,下列说法错误的是(
A.$ 18\ g\ H_2O $ 晶体内氢键的数目为 $ 2N_A $
B.$ 1\ L\ 1\ mol·L^{-1} $ 的 $ NaF $ 溶液中阳离子总数为 $ N_A $
C.$ 28\ g $ 环己烷和戊烯的混合物中碳原子的数目为 $ 2N_A $
D.铅酸蓄电池负极增重 $ 96\ g $,理论上转移电子数为 $ 2N_A $
B
)A.$ 18\ g\ H_2O $ 晶体内氢键的数目为 $ 2N_A $
B.$ 1\ L\ 1\ mol·L^{-1} $ 的 $ NaF $ 溶液中阳离子总数为 $ N_A $
C.$ 28\ g $ 环己烷和戊烯的混合物中碳原子的数目为 $ 2N_A $
D.铅酸蓄电池负极增重 $ 96\ g $,理论上转移电子数为 $ 2N_A $
答案:
3.B 18gH₂O的物质的量为1mol,1个H₂O分子平均能形成2个氢键,故1molH₂O晶体内氢键数目为2Nₐ,A正确;NaF溶液中阳离子有Na⁺、H⁺(由水电离产生),则1L1mol·L⁻¹NaF溶液中阳离子总数大于Nₐ,B错误;环己烷与戊烯的最简式均为CH₂,故28g环己烷与戊烯的混合物中碳原子的物质的量为$\frac{28g}{14g·mol⁻¹}$ = 2mol,碳原子的数目为2Nₐ,C正确;放电时,铅酸蓄电池负极的电极反应式为Pb + SO₄²⁻ - 2e⁻ = PbSO₄,电池负极增加的质量为SO₄²⁻的质量,n(SO₄²⁻) = $\frac{96g}{96g·mol⁻¹}$ = 1mol,结合负极的电极反应式可知,增加1molSO₄²⁻时,转移2mol电子,即转移电子数为2Nₐ,D正确。

3.B 18gH₂O的物质的量为1mol,1个H₂O分子平均能形成2个氢键,故1molH₂O晶体内氢键数目为2Nₐ,A正确;NaF溶液中阳离子有Na⁺、H⁺(由水电离产生),则1L1mol·L⁻¹NaF溶液中阳离子总数大于Nₐ,B错误;环己烷与戊烯的最简式均为CH₂,故28g环己烷与戊烯的混合物中碳原子的物质的量为$\frac{28g}{14g·mol⁻¹}$ = 2mol,碳原子的数目为2Nₐ,C正确;放电时,铅酸蓄电池负极的电极反应式为Pb + SO₄²⁻ - 2e⁻ = PbSO₄,电池负极增加的质量为SO₄²⁻的质量,n(SO₄²⁻) = $\frac{96g}{96g·mol⁻¹}$ = 1mol,结合负极的电极反应式可知,增加1molSO₄²⁻时,转移2mol电子,即转移电子数为2Nₐ,D正确。


4. (2025·黑吉辽蒙卷)钠及其化合物的部分转化关系如图。设 $ N_A $ 为阿伏加德罗常数的值,下列说法正确的是(
$ NaCl \xrightarrow[电解]{①} Na \xrightarrow[O_2]{②} Na_2O_2 \xrightarrow[H_2O]{③} NaOH \xrightarrow[Cl_2]{④} NaClO $
A.反应①生成的气体,每 $ 11.2\ L $(标准状况)含原子的数目为 $ N_A $
B.反应②中 $ 2.3\ g\ Na $ 完全反应生成的产物中含非极性键的数目为 $ 0.1N_A $
C.反应③中 $ 1\ mol\ Na_2O_2 $ 与足量 $ H_2O $ 反应转移电子的数目为 $ 2N_A $
D.$ 100\ mL\ 1\ mol·L^{-1}\ NaClO $ 溶液中, $ ClO^- $ 的数目为 $ 0.1N_A $
A
)$ NaCl \xrightarrow[电解]{①} Na \xrightarrow[O_2]{②} Na_2O_2 \xrightarrow[H_2O]{③} NaOH \xrightarrow[Cl_2]{④} NaClO $
A.反应①生成的气体,每 $ 11.2\ L $(标准状况)含原子的数目为 $ N_A $
B.反应②中 $ 2.3\ g\ Na $ 完全反应生成的产物中含非极性键的数目为 $ 0.1N_A $
C.反应③中 $ 1\ mol\ Na_2O_2 $ 与足量 $ H_2O $ 反应转移电子的数目为 $ 2N_A $
D.$ 100\ mL\ 1\ mol·L^{-1}\ NaClO $ 溶液中, $ ClO^- $ 的数目为 $ 0.1N_A $
答案:
4.A 反应①为2NaCl(熔融)$\stackrel{通电}{=\!=\!=}$2Na + Cl₂↑,标准状况下11.2LCl₂的物质的量为0.5mol,所含原子的数目为Nₐ,A正确;2.3gNa的物质的量为0.1mol,根据原子守恒可知,0.1molNa完全反应生成Na₂O₂的物质的量为0.05mol,1个Na₂O₂中含1个O—O非极性键,故产物中所含非极性键的数目为0.05Nₐ,B错误;反应③的化学方程式为2Na₂O₂ + 2H₂O = 4NaOH + O₂↑,该反应为歧化反应,Na₂O₂中O的化合价为 - 1,H₂O和NaOH中O的化合价为 - 2,O₂中O的化合价为0,故1molNa₂O₂与足量H₂O反应生成0.5molO₂,反应转移电子的数目为Nₐ,C错误;NaClO为强碱弱酸盐,ClO⁻会发生水解,导致ClO⁻的数目小于0.1Nₐ,D错误。
5. (2024·黑吉辽卷)硫及其化合物部分转化关系如图。设 $ N_A $ 为阿伏加德罗常数的值,下列说法正确的是(
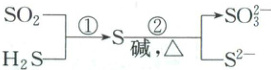
$ \begin{matrix} & & SO_2 & & \\ & & \downarrow & & \\ H_2S & \xrightarrow{①} & S & \xrightarrow[碱,\triangle]{②} & \begin{matrix} SO_3^{2-} \\ S^{2-} \end{matrix} \end{matrix} $
A.标准状况下, $ 11.2\ L\ SO_2 $ 中原子总数为 $ 0.5N_A $
B.$ 100\ mL\ 0.1\ mol·L^{-1}Na_2SO_3 $ 溶液中, $ SO_3^{2-} $ 数目为 $ 0.01N_A $
C.反应①每消耗 $ 3.4\ g\ H_2S $,生成物中硫原子数目为 $ 0.1N_A $
D.反应②每生成 $ 1\ mol $ 还原产物,转移电子数目为 $ 2N_A $
D
)
$ \begin{matrix} & & SO_2 & & \\ & & \downarrow & & \\ H_2S & \xrightarrow{①} & S & \xrightarrow[碱,\triangle]{②} & \begin{matrix} SO_3^{2-} \\ S^{2-} \end{matrix} \end{matrix} $
A.标准状况下, $ 11.2\ L\ SO_2 $ 中原子总数为 $ 0.5N_A $
B.$ 100\ mL\ 0.1\ mol·L^{-1}Na_2SO_3 $ 溶液中, $ SO_3^{2-} $ 数目为 $ 0.01N_A $
C.反应①每消耗 $ 3.4\ g\ H_2S $,生成物中硫原子数目为 $ 0.1N_A $
D.反应②每生成 $ 1\ mol $ 还原产物,转移电子数目为 $ 2N_A $
答案:
5.D 二氧化硫在标准状况下为气体,11.2L二氧化硫为0.5mol,其原子总数为1.5Nₐ,A错误;亚硫酸根离子在溶液中会水解,故亚硫酸根离子数目小于0.01Nₐ,B错误;反应①为2H₂S + SO₂ = 3S↓ + 2H₂O,则3.4g(0.1mol)硫化氢反应生成的硫原子数目为0.15Nₐ,C错误;反应②为3S + 6OH⁻ = 2S²⁻ + SO₃²⁻ + 3H₂O,每3molS发生反应转移4mol电子,其中2molS被还原,则每生成1mol还原产物S²⁻,转移2mol电子,D正确。
5.D 二氧化硫在标准状况下为气体,11.2L二氧化硫为0.5mol,其原子总数为1.5Nₐ,A错误;亚硫酸根离子在溶液中会水解,故亚硫酸根离子数目小于0.01Nₐ,B错误;反应①为2H₂S + SO₂ = 3S↓ + 2H₂O,则3.4g(0.1mol)硫化氢反应生成的硫原子数目为0.15Nₐ,C错误;反应②为3S + 6OH⁻ = 2S²⁻ + SO₃²⁻ + 3H₂O,每3molS发生反应转移4mol电子,其中2molS被还原,则每生成1mol还原产物S²⁻,转移2mol电子,D正确。

1. (2025·山东泰安二模) $ N_A $ 为阿伏加德罗常数的值,下列说法正确的是(
A.$ 1\ mol\ HClO $ 中所含 $ H—Cl $ 键的数目为 $ N_A $
B.$ 8.8\ g $ 乙酸乙酯中所含碳原子数为 $ 0.4N_A $
C.$ 1.2\ g\ C $ 与 $ 0.1\ mol\ CO_2 $ 在高温下充分反应生成的 $ CO $ 分子数为 $ 0.1N_A $
D.标准状况下, $ 1\ L\ 0.1\ mol·L^{-1}HCl $ 溶液中滴加氨水至 $ pH = 7 $,溶液中 $ NH_4^+ $ 的数目为 $ 0.1N_A $
B
)A.$ 1\ mol\ HClO $ 中所含 $ H—Cl $ 键的数目为 $ N_A $
B.$ 8.8\ g $ 乙酸乙酯中所含碳原子数为 $ 0.4N_A $
C.$ 1.2\ g\ C $ 与 $ 0.1\ mol\ CO_2 $ 在高温下充分反应生成的 $ CO $ 分子数为 $ 0.1N_A $
D.标准状况下, $ 1\ L\ 0.1\ mol·L^{-1}HCl $ 溶液中滴加氨水至 $ pH = 7 $,溶液中 $ NH_4^+ $ 的数目为 $ 0.1N_A $
答案:
1.B HClO的结构式为:H—O—Cl,不存在H—Cl,A错误;乙酸乙酯的分子式:C₄H₈O₂,8.8g为0.1mol,一个分子中含4个碳原子,碳原子数为0.4Nₐ,B正确;C + CO₂$\stackrel{高温}{=\!=\!=}$2CO,1.2gC为0.1mol,0.1molCO₂生成0.2molCO,即0.2Nₐ,C错误;常温时,pH = 7为中性,标准状况下pH = 7为酸性,即c(H⁺)>c(OH⁻),根据溶液呈电中性,则c(Cl⁻)>c(NH₄⁺),n(Cl⁻) = 0.1mol,NH₄⁺的数目小于0.1Nₐ,D错误。答案为B。
查看更多完整答案,请扫码查看


