2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第13页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·浙江温州三模)已知$H[AuCl_{4}]=H^{+}+[AuCl_{4}]^{-}$,向$H[AuCl_{4}]$溶液中加入足量Zn粉可以提炼Au,反应为:$HAuCl_{4}+Zn→Au+X+ZnCl_{2}$(未配平),下列说法不正确的是(
A.还原性:$Zn>Au$
B.X表示$H_{2}$
C.生成$1molAu$,转移电子总数为$3N_{A}$($N_{A}$表示阿伏加德罗常数的值)
D.氧化产物与还原产物的物质的量之比为$4:3$
C
)A.还原性:$Zn>Au$
B.X表示$H_{2}$
C.生成$1molAu$,转移电子总数为$3N_{A}$($N_{A}$表示阿伏加德罗常数的值)
D.氧化产物与还原产物的物质的量之比为$4:3$
答案:
2.C由题干信息可知,Zn能够置换出Au,说明还原性:$Zn>Au$,A正确;由题干信息可知,反应配平后的方程式为:$2HAuCl_4 + 4Zn \longrightarrow 2Au + H_2 \uparrow + 4ZnCl_2$,即X表示$H_2$,B正确;由B项分析可知,根据配平之后的反应方程式可知,生成$1molAu$,转移电子总数为$4N_A$,C错误;由B项分析可知,根据配平之后的反应方程式可知,氧化产物$ZnCl_2$与还原产物Au、$H_2$的物质的量之比为$4:3$,D正确;故答案为C。
3. (2025·安徽省池州市二模)硝酸厂烟气中含有大量氮氧化物$(NO_{x})$。常温下,将烟气与$H_{2}$的混合气体通入$Ce(SO_{4})_{2}$与$Ce_{2}(SO_{4})_{3}$的混合溶液中可实现无害化处理,其转化过程如图所示。下列说法正确的是(
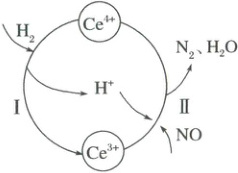
A.反应Ⅰ的离子方程式为$Ce^{4+}+H_{2}=Ce^{3+}+2H^{+}$
B.反应Ⅱ中氧化产物与还原产物的物质的量之比为$2:1$
C.该转化过程的实质是NO被$H_{2}$氧化
D.反应过程中混合溶液内$Ce^{3+}$和$Ce^{4+}$离子总数一定保持不变
D
)
A.反应Ⅰ的离子方程式为$Ce^{4+}+H_{2}=Ce^{3+}+2H^{+}$
B.反应Ⅱ中氧化产物与还原产物的物质的量之比为$2:1$
C.该转化过程的实质是NO被$H_{2}$氧化
D.反应过程中混合溶液内$Ce^{3+}$和$Ce^{4+}$离子总数一定保持不变
答案:
3.D根据进出图可知,$Ce^{4+}$把$H_2$氧化为$H^+$,自身被还原为$Ce^{3+}$,然后$Ce^{3+}$在酸性条件下再被$NO$氧化为$Ce^{4+}$,同时$NO$被还原为$N_2$,同时还生成水,据此解答。过程Ⅰ发生的反应为$Ce^{4+}$把$H_2$氧化为$H^+$,自身被还原为$Ce^{3+}$,反应的离子方程式为:$2Ce^{4+} + H_2 \longrightarrow 2Ce^{3+} + 2H^+$,故A错误;过程Ⅱ为$2NO + 4Ce^{3+} + 4H^+ \longrightarrow N_2 + 4Ce^{4+} + 2H_2O$,氧化产物为$Ce^{4+}$,还原产物为$N_2$,两者物质的量之比为$4:1$,故B错误;该转化过程的实质为$NO$被$H_2$还原为$N_2$,$H_2$被氧化为水,故C错误;处理过程中,$Ce^{3+}$和$Ce^{4+}$相互转化,反应前后质量不变,离子总数不变,故D正确;故选D。
4. 铁氰酸钾为深红色晶体,俗称“赤血盐”,常用来检验$Fe^{2+}$,碱性条件下可发生反应:$4K_{3}[Fe(CN)_{6}]+4KOH=4K_{4}[Fe(CN)_{6}]+O_{2}\uparrow+2H_{2}O$,下列说法不正确的是(
A.该反应中$K_{3}[Fe(CN)_{6}]$表现氧化性,被还原
B.$K_{3}[Fe(CN)_{6}]$溶液加入到含有$Fe^{2+}$的溶液中,生成的蓝色沉淀中铁元素存在两种价态
C.KOH作还原剂,$0.4molKOH$被氧化时,转移$0.4mol$电子
D.$0.1mol$铁氰酸钾参与反应时,生成标准状况下$O_{2}560mL$
C
)A.该反应中$K_{3}[Fe(CN)_{6}]$表现氧化性,被还原
B.$K_{3}[Fe(CN)_{6}]$溶液加入到含有$Fe^{2+}$的溶液中,生成的蓝色沉淀中铁元素存在两种价态
C.KOH作还原剂,$0.4molKOH$被氧化时,转移$0.4mol$电子
D.$0.1mol$铁氰酸钾参与反应时,生成标准状况下$O_{2}560mL$
答案:
4.CA项,$4K_3[Fe(CN)_6] + 4KOH \longrightarrow 4K_4[Fe(CN)_6] + O_2 \uparrow + 2H_2O$,$K_3[Fe(CN)_6]$铁的化合价从+3价变成产物中+2价,铁化合价降低,作氧化剂,被还原,故A正确;B项,生成的蓝色沉淀$Fe_3[Fe(CN)_6]_2$中铁元素存在+2、+3两种价态,故B正确;C项,$KOH$作还原剂,$0.4molKOH$被氧化时,转移$0.8mol$电子,故C错误;D项,$0.1mol$铁氰酸钾参与反应时,生成标准状况下$O_2560mL$,故D正确。
5. 亚氯酸钠$(NaClO_{2})$是一种重要的含氯消毒剂。马蒂逊法制备亚氯酸钠的流程如图,下列说法错误的是(
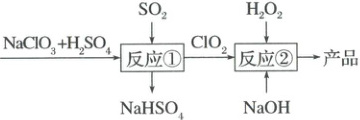
A.反应①阶段,参加反应的$NaClO_{3}$和$SO_{2}$的物质的量之比为$2:1$
B.反应②条件下,$ClO_{2}$的氧化性大于$H_{2}O_{2}$
C.反应②中的$H_{2}O_{2}$可用$NaClO_{4}$代替
D.若反应①通过原电池来实现,则$ClO_{2}$是正极产物
C
)
A.反应①阶段,参加反应的$NaClO_{3}$和$SO_{2}$的物质的量之比为$2:1$
B.反应②条件下,$ClO_{2}$的氧化性大于$H_{2}O_{2}$
C.反应②中的$H_{2}O_{2}$可用$NaClO_{4}$代替
D.若反应①通过原电池来实现,则$ClO_{2}$是正极产物
答案:
5.C根据流程图反应①中氧化剂是$NaClO_3$,还原剂是$SO_2$,还原产物是$ClO_2$,氧化产物是$NaHSO_4$,根据化合价升降相等可得$NaClO_3$和$SO_2$的物质的量之比为$2:1$,A项正确;根据流程图反应②$ClO_2$与$H_2O_2$反应的变价情况,$ClO_2$做氧化剂,$H_2O_2$做还原剂,可以推出$ClO_2$的氧化性大于$H_2O_2$,B项正确;根据流程图反应②,在$ClO_2$与$H_2O_2$的反应中,$ClO_2$转化为$NaClO_2$氯元素的化合价降低,做氧化剂;$H_2O_2$只能做还原剂,氧元素的化合价升高,不能用$NaClO_4$代替$H_2O_2$,C项错误;由反应①化合价变化情况,再根据原电池正极表面发生还原反应,所以$ClO_2$是正极产物,D项正确。
查看更多完整答案,请扫码查看


