2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·辽宁抚顺二模)25℃时,用同一NaOH溶液分别滴定一元酸HA溶液和$CuSO_{4}$溶液,pM[p表示负对数,M表示$\frac{c(A^{-})}{c(HA)}$、$c(Cu^{2+})$]与溶液pH的变化关系如图所示。已知:$CuA_{2}$易溶于水,一般认为反应的平衡常数$K>10^{5}$时反应进行完全。下列说法错误的是(
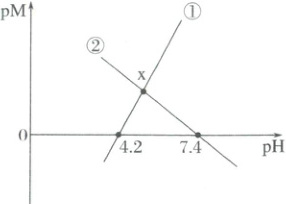
A.线①代表滴定$CuSO_{4}$溶液时pM与溶液pH的变化关系
B.HA为一元弱酸,25℃时其$K_{a}$的数量级为$10^{-8}$
C.滴定HA溶液至x点时,溶液中$c(HA)>c(A^{-})>c(Na^{+})>c(H^{+})>c(OH^{-})$
D.滴定$CuSO_{4}$溶液至x点时,改为滴加HA溶液,沉淀可完全溶解
D
)
A.线①代表滴定$CuSO_{4}$溶液时pM与溶液pH的变化关系
B.HA为一元弱酸,25℃时其$K_{a}$的数量级为$10^{-8}$
C.滴定HA溶液至x点时,溶液中$c(HA)>c(A^{-})>c(Na^{+})>c(H^{+})>c(OH^{-})$
D.滴定$CuSO_{4}$溶液至x点时,改为滴加HA溶液,沉淀可完全溶解
答案:
1.D氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,随着$NaOH$溶液的滴加,$pH$增大,故$c(Cu^{2+})$逐渐减小,$-\lg c(Cu^{2+})$变大,所以曲线①代表滴定$CuSO_{4}$溶液时$pM$与溶液$pH$的变化关系,曲线②代表滴定一元酸$HA$溶液时$pM$与$pH$的变化关系,A正确;由A项分析可知,从线②与横坐标轴的交点时$c(H^{+})=10^{-7.4} mol·L^{-1}$,$\frac{c(A^{-})}{c(HA)}=1$时,$K_{a}=\frac{c(A^{-})· c(H^{+})}{c(HA)}=c(H^{+})=10^{-7.4}$,则$HA$为一元弱酸,$25 °C$时其$K_{a}$的数量级为$10^{-8}$,B正确;$x$点溶液呈酸性,则$c(H^{+})>c(OH^{-})$,根据电荷守恒得$c(H^{+})+c(Na^{+})=c(OH^{-})+c(A^{-})$,所以$c(A^{-})>c(Na^{+})>c(H^{+})>c(OH^{-})$,再根据$x$点的$pM>0$,即$c(A^{-})<c(HA)$,可得$c(HA)>c(A^{-})>c(Na^{+})>c(H^{+})>c(OH^{-})$,C正确;若发生反应$Cu(OH)_{2}(s)+2HA(aq)\rightleftharpoonsCu^{2+}(aq)+2H_{2}O(l)+2A^{-}(aq)$,则该反应的$K=\frac{c(Cu^{2+})· c^{2}(A^{-})}{c^{2}(HA)}=\frac{c(Cu^{2+})· c^{2}(A^{-})· c^{2}(OH^{-})}{c^{2}(HA)· c^{2}(OH^{-})}=\frac{K_{sp}[Cu(OH)_{2}]· K^{2}_{a}}{c^{2}(HA)· c^{2}(OH^{-})· c^{2}(H^{+})}=\frac{K_{sp}[Cu(OH)_{2}]· K^{2}_{a}}{K^{2}_{w}}$,根据线①与横坐标轴的交点可知$pM=0$,即$c(Cu^{2+})=1.0 mol·L^{-1}$时,$c(OH^{-})=\frac{10^{-14}}{10^{-4.2}}=10^{-9.8}(mol/L)$,所以$K_{sp}[Cu(OH)_{2}]=c(Cu^{2+})· c^{2}(OH^{-})=10^{-19.6}$,$K=10^{-19.6}×\frac{(10^{-7.4})^{2}}{(10^{-14})^{2}}=10^{-6.4}<10^{5}$,故沉淀不能完全溶解,D错误;故答案为D。
查看更多完整答案,请扫码查看


