2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·江西二模)$25^{\circ}C$时向$10\ mL$某浓度新制氯水中滴入$0.1\ mol·L^{-1}$的${NaOH}$溶液,滴定曲线如图所示。已知次氯酸的电离平衡常数为$K_{a} = 2.5×10^{-8}$。下列说法正确的是(
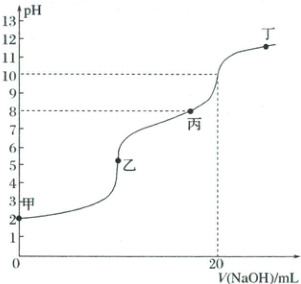
A.该实验过程可以用$pH$试纸测量溶液的$pH$值
B.甲点溶液中存在:$n({Cl_{2}}) + n({HClO}) + n({Cl^{-}}) + n({ClO^{-}}) = 0.01N_{A}$
C.丙点溶液中:$c(Na^{+}) > c(Cl^{-}) > c(ClO^{-}) > c({HClO}) > c(H^{+})$
D.氯水中存在平衡:${Cl_{2}(aq) + H_{2}O(l)⇌ H^{+}(aq) + Cl^{-}(aq) + HClO(aq)}$该反应的平衡常数$K$的数量级为$10^{-6}$
C
)
A.该实验过程可以用$pH$试纸测量溶液的$pH$值
B.甲点溶液中存在:$n({Cl_{2}}) + n({HClO}) + n({Cl^{-}}) + n({ClO^{-}}) = 0.01N_{A}$
C.丙点溶液中:$c(Na^{+}) > c(Cl^{-}) > c(ClO^{-}) > c({HClO}) > c(H^{+})$
D.氯水中存在平衡:${Cl_{2}(aq) + H_{2}O(l)⇌ H^{+}(aq) + Cl^{-}(aq) + HClO(aq)}$该反应的平衡常数$K$的数量级为$10^{-6}$
答案:
1.C 由图可知,用NaOH溶液滴定氯水,滴定过程中有两个突变点,则从甲到乙,主要发生HCl与NaOH的反应;从乙到pH=10的点,主要发生HClO与NaOH的反应。由图可知,加入20mL氢氧化钠溶液恰好生成氯化钠和次氯酸钠,结合元素质量守恒,氯原子总量为$0.1mol· L^{-1}×0.02L=0.002mol$,据此解答。氯水中的次氯酸具有强氧化性,则氯水具有漂白性,玻璃棒蘸取该溶液滴至pH试纸上会先变色后褪色,所以该实验过程不可以用pH试纸测量溶液的pH值,A错误;由分析可知,结合氯元素守恒,甲点溶液中存在:$2n(Cl_2)+n(HClO)+n(Cl^-)+n(ClO^-)=0.002N_A$,B错误;丙点溶液中含有NaCl、NaClO、HClO,此时$c(H^+)=10^{-8}mol/L$,则$K_a=\frac{c(H^+)c(ClO^-)}{c(HClO)}=\frac{10^{-8}c(ClO^-)}{c(HClO)}=2.5×10^{-8}$,$c(ClO^-)=2.5c(HClO)$,结合反应$Cl_2+H_2O\rightleftharpoons HClO+HCl$,则$c(Cl^-)=c(ClO^-)+c(HClO)$,所以丙点溶液中:$c(Na^+)>c(Cl^-)>c(ClO^-)>c(HClO)>c(H^+)$,C正确;氯水中存在平衡:$Cl_2(aq)+H_2O(l)\rightleftharpoons H^+(aq)+Cl^-(aq)+HClO(aq)$,pH=10时,$Cl_2$与NaOH刚好完全反应,由$Cl_2+2NaOH=NaCl+NaClO+H_2O$,可求出$c(Cl_2)=\frac{0.1mol· L^{-1}×0.02L×\frac{1}{2}}{0.01L}=0.1mol/L$,根据起点pH=2,有$c(H^+)=c(Cl^-)=c(HClO)=0.01mol/L$,此时$c(Cl_2)=0.1-c(H^+)$,其平衡常数$K=\frac{c(H^+)c(Cl^-)c(HClO)}{c(Cl_2)}=\frac{0.01×0.01×0.01}{0.1-0.01}\approx10^{-5}$,即该反应的平衡常数K的数量级为$10^{-5}$,错误;故选C。
2. (2025·贵州毕节二模)常温下,用浓度为$0.0200\ mol·L^{-1}$的${NaOH}$标准溶液滴定浓度均为$0.0200\ mol·L^{-1}$的${HCl}$和${CH_{3}COOH}$的混合溶液,滴定过程中溶液的$pH$随$\eta$($\eta=\dfrac{V(标准溶液)}{V(待测溶液)}$)的变化曲线如图所示。已知:$K_{a}({CH_{3}COOH}) = 10^{-4.76}$。下列说法错误的是(
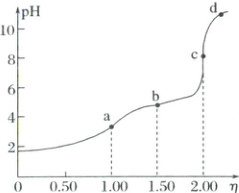
A.a点溶液$pH$约为$3.38$
B.b点:$c({CH_{3}COOH}) < c({CH_{3}COO^{-}})$
C.c点:$c(Na^{+}) = 2c({CH_{3}COO^{-}}) + 2c({CH_{3}COOH})$
D.$pH = 7$时,$c(Na^{+}) = c(Cl^{-}) + c({CH_{3}COOH})$
D
)
A.a点溶液$pH$约为$3.38$
B.b点:$c({CH_{3}COOH}) < c({CH_{3}COO^{-}})$
C.c点:$c(Na^{+}) = 2c({CH_{3}COO^{-}}) + 2c({CH_{3}COOH})$
D.$pH = 7$时,$c(Na^{+}) = c(Cl^{-}) + c({CH_{3}COOH})$
答案:
2.D NaOH溶液和HCl、$CH_3COOH$混酸反应时,先与强酸反应,然后再与弱酸反应,由滴定曲线可知,a点时NaOH溶液和HCl恰好完全反应生成NaCl和水,$CH_3COOH$未发生反应,溶质成分为NaCl和$CH_3COOH$;b点时NaOH溶液反应掉一半的$CH_3COOH$,溶质成分为NaCl、$CH_3COOH$和$CH_3COONa$;c点时NaOH溶液与$CH_3COOH$恰好完全反应,溶质成分为NaCl、$CH_3COONa$;d点时NaOH过量,溶质成分为NaCl、$CH_3COONa$和NaOH,据此解答。由分析可知,a点时溶质成分为NaCl和$CH_3COOH$,$c(CH_3COOH)=0.0100mol/L$,$c(H^+)=c(CH_3COO^-)$,则$K_a=\frac{c(H^+)c(CH_3COO^-)}{c(CH_3COOH)}=\frac{c^2(H^+)}{0.01}=10^{-4.76}$,$c(H^+)=\sqrt{10^{-6.76}}=10^{-3.38}(mol· L^{-1})$,$pH=3.38$,故A正确;点b溶液中含有NaCl及等浓度的$CH_3COOH$和$CH_3COONa$,由于$pH<7$,溶液显酸性,说明$CH_3COOH$的电离程度大于$CH_3COO^-$的水解程度,则$c(CH_3COOH)<c(CH_3COO^-)$,故B正确;由分析可知,c点时溶质成分为NaCl、$CH_3COONa$,且浓度比为1:1,根据元素质量守恒:$c(Na^+)=2c(CH_3COOH)+2c(CH_3COO^-)$,故C正确;pH=7时$c(H^+)=c(OH^-)$,则根据电荷守恒:$c(Na^+)=c(Cl^-)+c(CH_3COO^-)$,故D错误;故答案为D。
查看更多完整答案,请扫码查看


