2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
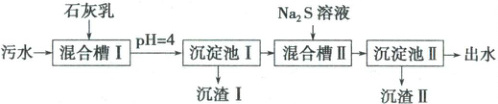
【例题分析】(2023·湖南卷)处理某铜冶金污水(含${Cu^{2+}}$、${Fe^{3+}}$、${Zn^{2+}}$、${Al^{3+}}$)的部分流程如下:
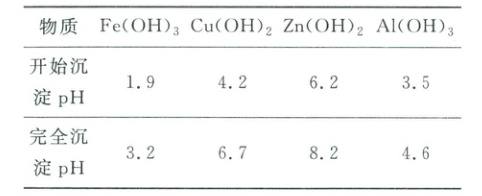
已知:①溶液中金属离子开始沉淀和完全沉淀的${pH}$如下表所示:
②$K_{sp}({CuS}) = 6.4× 10^{-36}$,$K_{sp}({ZnS}) = 1.6× 10^{-24}$。
下列说法错误的是(
A. “沉渣Ⅰ”中含有${Fe(OH)_{3}}$和${Al(OH)_{3}}$
B. ${Na_{2}S}$溶液呈碱性,其主要原因是${S^{2-} + H_{2}O⇌ HS^{-} + OH^{-}}$
C. “沉淀池Ⅱ”中,当${Cu^{2+}}$和${Zn^{2+}}$完全沉淀时,溶液中$\dfrac{c({Cu^{2+}})}{c({Zn^{2+}})} = 4.0× 10^{-12}$
D. “出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水

已知:①溶液中金属离子开始沉淀和完全沉淀的${pH}$如下表所示:

②$K_{sp}({CuS}) = 6.4× 10^{-36}$,$K_{sp}({ZnS}) = 1.6× 10^{-24}$。
下列说法错误的是(
D
)A. “沉渣Ⅰ”中含有${Fe(OH)_{3}}$和${Al(OH)_{3}}$
B. ${Na_{2}S}$溶液呈碱性,其主要原因是${S^{2-} + H_{2}O⇌ HS^{-} + OH^{-}}$
C. “沉淀池Ⅱ”中,当${Cu^{2+}}$和${Zn^{2+}}$完全沉淀时,溶液中$\dfrac{c({Cu^{2+}})}{c({Zn^{2+}})} = 4.0× 10^{-12}$
D. “出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
答案:
[答案] D
(2)分析流程图、装置图中的每一步操作及步骤
(3)逐项判断,不遗漏信息
【解题建模】
(1)明确制备物质特点
(1)明确制备物质特点
首先确定要制备什么物质,从题干或流程图、装置图中获取有用信息,了解制备物质的性质,具有某些特殊性质的产物,要采取必要的措施来避免在制备过程中产生杂质。
(2)分析流程图、装置图中的每一步操作及步骤
从以下几个方面了解流程图、装置图:反应物是什么?反应方程式是什么?该反应有何作用?对制备结果有何影响?
(3)逐项判断,不遗漏信息
结合除杂、分离、提纯等实验操作,灵活运用元素化合物及氧化还原反应等知识,从问题中获取解题信息,逐项判断。
1. (2025·河南许平汝名校二模)亚氯酸钠(${NaClO_{2}}$,受热易分解)是一种重要的含氯消毒剂,一种制备${NaClO_{2}}$的工艺流程如图所示,下列说法错误的是(
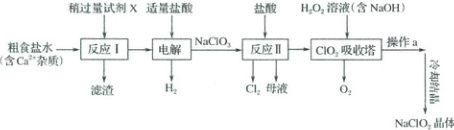
A.“滤渣”的主要成分为${CaCO_{3}}$
B.流程中两处盐酸的作用相同
C.操作$a$为“减压蒸发”
D.理论上,该流程中$n({Cl_{2}}):n({O_{2}}) = 1:1$
B
)
A.“滤渣”的主要成分为${CaCO_{3}}$
B.流程中两处盐酸的作用相同
C.操作$a$为“减压蒸发”
D.理论上,该流程中$n({Cl_{2}}):n({O_{2}}) = 1:1$
答案:
1.B 粗食盐水中含有杂质$Ca^{2 + }$,加入过量碳酸钠可将所有$Ca^{2 + }$完全沉淀,故滤渣为$CaCO_{3}$,A项正确,流程中两处盐酸,第一次用盐酸是除碳酸钠,第二次用盐酸是还原氯酸钠生成二氧化氯,两处$HCl$的作用不相同,B项错误;由于$NaClO_{2}$受热易分解,因此利用减压蒸发,C项正确;反应Ⅱ中产生$Cl_{2}$的化学方程式为$2NaClO_{3} + 4HCl=2ClO_{2}\uparrow + Cl_{2}\uparrow + 2NaCl + 2H_{2}O$,$ClO_{2}$吸收塔中产生$O_{2}$的化学方程式为$2ClO_{2} + 2NaOH + H_{2}O_{2}=2NaClO_{2} + O_{2}\uparrow + 2H_{2}O$,故理论上,产生$Cl_{2}、O_{2}$的物质的量之比为$1:1$,D项正确。答案选B。
2. (2025·江苏常州二模)${CuCl}$难溶于水和乙醇,在潮湿空气中易被氧化。以碱性蚀刻废液中的${[Cu(NH_{3})_{4}]Cl_{2}}$为原料制备${CuCl}$的部分流程如下。下列说法正确的是(
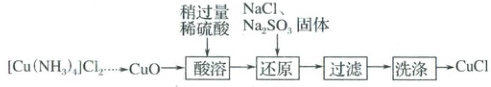
A.${[Cu(NH_{3})_{4}]Cl_{2}}$溶于水所得溶液中$c({NH_{3}}):c({Cl^{-}}) = 2:1$
B.“酸溶”时不用稀硝酸的主要原因是硝酸易挥发
C.“还原”后溶液的${pH}$增大
D.“洗涤”时先用水再用乙醇会降低产品的纯度
D
)
A.${[Cu(NH_{3})_{4}]Cl_{2}}$溶于水所得溶液中$c({NH_{3}}):c({Cl^{-}}) = 2:1$
B.“酸溶”时不用稀硝酸的主要原因是硝酸易挥发
C.“还原”后溶液的${pH}$增大
D.“洗涤”时先用水再用乙醇会降低产品的纯度
答案:
2.D 配合物$[Cu(NH_{3})_{4}]Cl_{2}$中四氨合铜离子为内界、氯离子为外界,配合物在溶液中电离出四氨合铜离子和氯离子,不能电离出氨分子,故A错误;“酸溶”时不用稀硝酸的主要原因是稀硝酸具有强氧化性,会将亚硫酸根离子氧化为硫酸根离子,导致亚硫酸根离子无法将溶液中的铜离子还原为氯化亚铜沉淀,故B错误;由分析可知,“还原”发生的反应为$2Cu^{2 + } + SO_{3}^{2 - } + 2Cl^{-} + H_{2}O=2CuCl\downarrow + SO_{4}^{2 - } + 2H^{ + }$,反应生成的氢离子会使溶液$pH$减小,故C错误;由题意可知,氯化亚铜在潮湿空气中易被氧化,所以“洗涤”时先用水再用乙醇会使氯化亚铜被氧化,降低产品的纯度,故D正确;故选D。
3. (2025·山东泰安模拟)某种电镀污泥主要含有碲化亚铜(${Cu_{2}Te}$)、三氧化二铬以及少量的金,用于制取${K_{2}Cr_{2}O_{7}}$、金属铜和粗碲工艺流程如下:
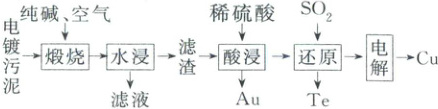
已知:煅烧时${Cu_{2}Te}$被氧化为${CuO}$和${TeO_{2}}$;最高价铬酸根在酸性介质中以${Cr_{2}O^{2-}_{7}}$存在,在碱性介质中以${CrO^{2-}_{4}}$存在;酸浸时${TeO_{2}}$转化为${TeO^{2+}}$。下列说法错误的是(
A.“煅烧”时,${Cr_{2}O_{3}}$发生反应的化学方程式是${2Cr_{2}O_{3} + 3O_{2} + 4Na_{2}CO_{3}\xlongequal{高温}4Na_{2}CrO_{4} + 4CO_{2}}$
B.滤液中加入${KCl}$,通过适当的分离操作可得到${K_{2}Cr_{2}O_{7}}$
C.${Te}$在元素周期表中与${S}$同主族,${TeO^{2+}}$既有氧化性又有还原性
D.“电解”后的溶液可用于“酸浸”

已知:煅烧时${Cu_{2}Te}$被氧化为${CuO}$和${TeO_{2}}$;最高价铬酸根在酸性介质中以${Cr_{2}O^{2-}_{7}}$存在,在碱性介质中以${CrO^{2-}_{4}}$存在;酸浸时${TeO_{2}}$转化为${TeO^{2+}}$。下列说法错误的是(
B
)A.“煅烧”时,${Cr_{2}O_{3}}$发生反应的化学方程式是${2Cr_{2}O_{3} + 3O_{2} + 4Na_{2}CO_{3}\xlongequal{高温}4Na_{2}CrO_{4} + 4CO_{2}}$
B.滤液中加入${KCl}$,通过适当的分离操作可得到${K_{2}Cr_{2}O_{7}}$
C.${Te}$在元素周期表中与${S}$同主族,${TeO^{2+}}$既有氧化性又有还原性
D.“电解”后的溶液可用于“酸浸”
答案:
3.B 由流程图可知,煅烧时,$Cr_{2}O_{3}$与$Na_{2}CO_{3}$、$O_{2}$反应生成了$Na_{2}CrO_{4}$和$CO_{2}$,化学方程式为$2Cr_{2}O_{3} + 3O_{2} + 4Na_{2}CO_{3}\xlongequal{高温}4Na_{2}CrO_{4} + 4CO_{2}$,A正确;$Cr_{2}O_{3}$与纯碱和空气中的氧气反应生成$Na_{2}CrO_{4}$,但得到的滤液中还含有$Na_{2}CO_{3}$,滤液需要酸化除去$Na_{2}CO_{3}$,$Na_{2}CrO_{4}$转化为$Na_{2}Cr_{2}O_{7}$,再加入$KCl$,$Na_{2}Cr_{2}O_{7}$转化为$K_{2}Cr_{2}O_{7}$,蒸发浓缩、冷却结晶、过滤可得到$K_{2}Cr_{2}O_{7}$,B错误;$Te$在元素周期表中与$S$同主族,均位于第ⅥA族,$TeO^{2 - }_{2}$中$Te$的化合价为$ + 4$价,$Te$元素化合价既可以上升,也可以下降,$TeO^{2 - }_{2}$既有氧化性又有还原性,C正确;电解的溶液主要溶质为硫酸铜,电解时发生反应:通电$2CuSO_{4} + 2H_{2}O=2Cu + O_{2}\uparrow + 2H_{2}SO_{4}$;生成的硫酸可返回酸浸工序循环使用,D正确;故选B。
查看更多完整答案,请扫码查看


