2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·黑吉辽蒙卷) 乙二醇是一种重要化工原料,以合成气 (CO、$ H_2 $) 为原料合成乙二醇具有重要意义。
Ⅰ. 直接合成法:$ 2CO(g) + 3H_2(g) \xlongequal{催化剂} HOCH_2CH_2OH(g) $,不同温度下平衡常数如表所示。
(1) 该反应的 $ \Delta H $
(2) 已知 $ CO(g) $、$ H_2(g) $、$ HOCH_2CH_2OH(g) $ 的燃烧热 ($ \Delta H $) 分别为 $ -a \, kJ · mol^{-1} $、$ -b \, kJ · mol^{-1} $、$ -c \, kJ · mol^{-1} $,则上述合成反应的 $ \Delta H = $
(3) 实验表明,在 500 K 时,即使压强 (34 MPa) 很高乙二醇产率 (7%) 也很低,可能的原因是 ______ (答出 1 条即可)。
Ⅱ. 间接合成法:用合成气和 $ O_2 $ 制备的 DMO 合成乙二醇,发生如下 3 个均放热的连续反应,其中 MG 生成乙二醇的反应为可逆反应。
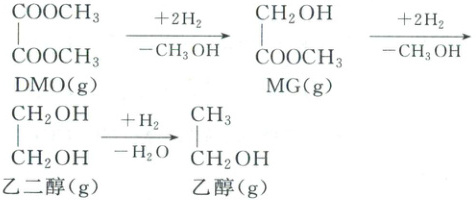
(4) 在 2 MPa、$ Cu/SiO_2 $ 催化、固定流速条件下,发生上述反应,初始氢酯比 $ \frac{n(H_2)}{n(DMO)} = 52.4 $,出口处检测到 DMO 的实际转化率及 MG、乙二醇、乙醇的选择性随温度的变化曲线如图所示 [某物质的选择性 $ = \frac{n_{生成}(该物质)}{n_{消耗}(DMO)} × 100\% $]。
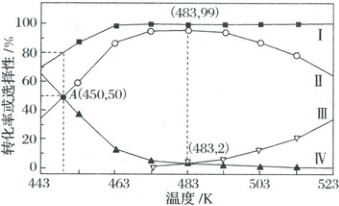
① 已知曲线Ⅱ表示乙二醇的选择性,则曲线 ______ (填图中标号,下同) 表示 DMO 的转化率,曲线 ______ 表示 MG 的选择性。
② 有利于提高 A 点 DMO 转化率的措施有
A. 降低温度
B. 增大压强
C. 减小初始氢酯比
D. 延长原料与催化剂的接触时间
③ 483 K 时,出口处 $ \frac{n(乙醇)}{n(DMO)} $ 的值为
④ A 点反应 $ MG(g) + 2H_2(g) \xlongequal{} HOCH_2CH_2OH(g) + CH_3OH(g) $ 的浓度商 $ Q_x = $
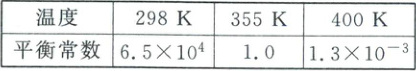
Ⅰ. 直接合成法:$ 2CO(g) + 3H_2(g) \xlongequal{催化剂} HOCH_2CH_2OH(g) $,不同温度下平衡常数如表所示。
(1) 该反应的 $ \Delta H $
<
0 (填“>”或“<”)。(2) 已知 $ CO(g) $、$ H_2(g) $、$ HOCH_2CH_2OH(g) $ 的燃烧热 ($ \Delta H $) 分别为 $ -a \, kJ · mol^{-1} $、$ -b \, kJ · mol^{-1} $、$ -c \, kJ · mol^{-1} $,则上述合成反应的 $ \Delta H = $
$-2a - 3b + c$
$ kJ · mol^{-1} $ (用 $ a $、$ b $ 和 $ c $ 表示)。(3) 实验表明,在 500 K 时,即使压强 (34 MPa) 很高乙二醇产率 (7%) 也很低,可能的原因是 ______ (答出 1 条即可)。
Ⅱ. 间接合成法:用合成气和 $ O_2 $ 制备的 DMO 合成乙二醇,发生如下 3 个均放热的连续反应,其中 MG 生成乙二醇的反应为可逆反应。

(4) 在 2 MPa、$ Cu/SiO_2 $ 催化、固定流速条件下,发生上述反应,初始氢酯比 $ \frac{n(H_2)}{n(DMO)} = 52.4 $,出口处检测到 DMO 的实际转化率及 MG、乙二醇、乙醇的选择性随温度的变化曲线如图所示 [某物质的选择性 $ = \frac{n_{生成}(该物质)}{n_{消耗}(DMO)} × 100\% $]。

① 已知曲线Ⅱ表示乙二醇的选择性,则曲线 ______ (填图中标号,下同) 表示 DMO 的转化率,曲线 ______ 表示 MG 的选择性。
② 有利于提高 A 点 DMO 转化率的措施有
BD
(填标号)。A. 降低温度
B. 增大压强
C. 减小初始氢酯比
D. 延长原料与催化剂的接触时间
③ 483 K 时,出口处 $ \frac{n(乙醇)}{n(DMO)} $ 的值为
1.98
(精确至 0.01)。④ A 点反应 $ MG(g) + 2H_2(g) \xlongequal{} HOCH_2CH_2OH(g) + CH_3OH(g) $ 的浓度商 $ Q_x = $
0.025
(用物质的量分数代替浓度计算,精确至 0.001)。
答案:
2.答案:
(1)<
(2)$-2a - 3b + c$(或$c - 2a - 3b$)
(3)平衡常数太小(或催化剂失活)
(4)①Ⅳ②BD③1.98④0.025
解析:
(1)根据表中数据可知,该反应的平衡常数随温度升高而减小,说明正反应放热,即$\Delta H<0$。
(2)燃烧热是指在101kPa时,1mol纯物质完全燃烧生成指定产物所放出的热量,则根据已知条件可以写出热化学方程式:①$\mathrm{CO(g)+\frac{1}{2}O_2(g)=CO_2(g)}\ \Delta H_1=-a\ \mathrm{kJ· mol^{-1}}$、②$\mathrm{H_2(g)+\frac{1}{2}O_2(g)=H_2O(l)}\ \Delta H_2=-b\ \mathrm{kJ· mol^{-1}}$、③$\mathrm{HOCH_2CH_2OH(g)+\frac{5}{2}O_2(g)=2CO_2(g)+3H_2O(l)}\ \Delta H_3=-c\ \mathrm{kJ· mol^{-1}}$,根据盖斯定律,题给反应=$2×$反应①+$3×$反应②-反应③,故合成反应的$\Delta H=(-2a - 3b + c)\mathrm{kJ· mol^{-1}}$。
(3)乙二醇产率(平衡产率或一定时间内的产率)很低,根据表中数据知,500K时平衡常数小于$1.3×10^{-3}$,平衡常数小(反应正向进行程度小)会导致平衡产率低;注意到反应条件中有催化剂,500K下催化剂可能失去活性而导致一定时间内的产率低。
(4)①根据间接合成法的3个连续反应可知,消耗的DMO的物质的量等于三种产物MG、乙二醇、乙醇的物质的量之和,根据物质选择性的定义,图中三种物质在任一温度下的选择性之和为100%,故曲线Ⅰ表示DMO的转化率。由于三个反应为连续反应,随着温度升高,反应速率不断增大,体系中的物质会不断向最终产物乙醇转化,因此选择性随温度升高而不断升高的曲线Ⅲ表示乙醇的选择性,曲线Ⅳ表示MG的选择性。②由于DMO→MG为不可逆反应因此要提高A点DMO转化率,可通过提高其反应速率或延长反应时间的方法来达到。降低温度会降低反应速率,A项错误;增大压强可提高反应速率B项正确;减小初始氢酯比相当于增大DMO的含量,不能提高DMO的转化率,C项错误;延长原料与催化剂的接触时间相当于延长反应时间,D项正确。③设DMO初始投入量为1mol,483K时DMO的转化率为99%,则三种产物的物质的量之和为0.99mol,此时$n(\mathrm{DMO})=0.01\mathrm{mol}$;483K时乙醇的选择性为2%,则$n(\mathrm{乙醇})=0.0198\mathrm{mol}$,故$\frac{n(\mathrm{乙醇})}{n(\mathrm{DMO})}=\frac{0.0198\mathrm{mol}}{0.01\mathrm{mol}}=1.98$④设DMO初始投入量为1mol,根据初始氢酯比$\frac{n(\mathrm{H_2})}{n(\mathrm{DMO})}=52.4$,则初始投入52.4mol$\mathrm{H_2}$,A点没有生成乙醇,只涉及前两个反应:$\mathrm{DMO+2H_2=MG+CH_3OH}$、$\mathrm{MG+2H_2=HOCH_2CH_2OH+CH_3OH}$,设A点处两个反应分别消耗了$x\mathrm{mol}$DMO、$y\mathrm{mol}$MG,A点时各物质的物质的量$n(\mathrm{DMO})=(1 - x)\mathrm{mol}$,$n(\mathrm{H_2})=(52.4 - 2x - 2y)\mathrm{mol}$,$n(\mathrm{MG})=(x - y)\mathrm{mol}$,$n(\mathrm{HOCH_2CH_2OH})=y\mathrm{mol}$,$n(\mathrm{CH_3OH})=(x + y)\mathrm{mol}$,根据A点DMO的转化率为80%可知$x = 0.8$;根据A点乙二醇和MG的选择性均为50%可知二者物质的量相同,即$x - y = y$,将$x = 0.8$代入得$y = 0.4$,则$n(\mathrm{DMO})=0.2\mathrm{mol}$,A点时,$n(\mathrm{H_2})=50\mathrm{mol}$,$n(\mathrm{MG})=0\mathrm{mol}$,$n(\mathrm{HOCH_2CH_2OH})=0.4\mathrm{mol}$,$n(\mathrm{CH_3OH})=1.2\mathrm{mol}$,$n_总=52.2\mathrm{mol}$,故题给反应的$Q_x=\frac{x(\mathrm{HOCH_2CH_2OH})· x(\mathrm{CH_3OH})}{x(\mathrm{MG})· x^2(\mathrm{H_2})}=\frac{n(\mathrm{HOCH_2CH_2OH})}{n_总}·\frac{n(\mathrm{CH_3OH})}{n_总·(\frac{n_总}{n_总})^2}=\frac{0.4}{52.2}×\frac{1.2}{52.2}×(\frac{50}{52.2})^{-2}\approx0.025$[另解:设起始
(1)<
(2)$-2a - 3b + c$(或$c - 2a - 3b$)
(3)平衡常数太小(或催化剂失活)
(4)①Ⅳ②BD③1.98④0.025
解析:
(1)根据表中数据可知,该反应的平衡常数随温度升高而减小,说明正反应放热,即$\Delta H<0$。
(2)燃烧热是指在101kPa时,1mol纯物质完全燃烧生成指定产物所放出的热量,则根据已知条件可以写出热化学方程式:①$\mathrm{CO(g)+\frac{1}{2}O_2(g)=CO_2(g)}\ \Delta H_1=-a\ \mathrm{kJ· mol^{-1}}$、②$\mathrm{H_2(g)+\frac{1}{2}O_2(g)=H_2O(l)}\ \Delta H_2=-b\ \mathrm{kJ· mol^{-1}}$、③$\mathrm{HOCH_2CH_2OH(g)+\frac{5}{2}O_2(g)=2CO_2(g)+3H_2O(l)}\ \Delta H_3=-c\ \mathrm{kJ· mol^{-1}}$,根据盖斯定律,题给反应=$2×$反应①+$3×$反应②-反应③,故合成反应的$\Delta H=(-2a - 3b + c)\mathrm{kJ· mol^{-1}}$。
(3)乙二醇产率(平衡产率或一定时间内的产率)很低,根据表中数据知,500K时平衡常数小于$1.3×10^{-3}$,平衡常数小(反应正向进行程度小)会导致平衡产率低;注意到反应条件中有催化剂,500K下催化剂可能失去活性而导致一定时间内的产率低。
(4)①根据间接合成法的3个连续反应可知,消耗的DMO的物质的量等于三种产物MG、乙二醇、乙醇的物质的量之和,根据物质选择性的定义,图中三种物质在任一温度下的选择性之和为100%,故曲线Ⅰ表示DMO的转化率。由于三个反应为连续反应,随着温度升高,反应速率不断增大,体系中的物质会不断向最终产物乙醇转化,因此选择性随温度升高而不断升高的曲线Ⅲ表示乙醇的选择性,曲线Ⅳ表示MG的选择性。②由于DMO→MG为不可逆反应因此要提高A点DMO转化率,可通过提高其反应速率或延长反应时间的方法来达到。降低温度会降低反应速率,A项错误;增大压强可提高反应速率B项正确;减小初始氢酯比相当于增大DMO的含量,不能提高DMO的转化率,C项错误;延长原料与催化剂的接触时间相当于延长反应时间,D项正确。③设DMO初始投入量为1mol,483K时DMO的转化率为99%,则三种产物的物质的量之和为0.99mol,此时$n(\mathrm{DMO})=0.01\mathrm{mol}$;483K时乙醇的选择性为2%,则$n(\mathrm{乙醇})=0.0198\mathrm{mol}$,故$\frac{n(\mathrm{乙醇})}{n(\mathrm{DMO})}=\frac{0.0198\mathrm{mol}}{0.01\mathrm{mol}}=1.98$④设DMO初始投入量为1mol,根据初始氢酯比$\frac{n(\mathrm{H_2})}{n(\mathrm{DMO})}=52.4$,则初始投入52.4mol$\mathrm{H_2}$,A点没有生成乙醇,只涉及前两个反应:$\mathrm{DMO+2H_2=MG+CH_3OH}$、$\mathrm{MG+2H_2=HOCH_2CH_2OH+CH_3OH}$,设A点处两个反应分别消耗了$x\mathrm{mol}$DMO、$y\mathrm{mol}$MG,A点时各物质的物质的量$n(\mathrm{DMO})=(1 - x)\mathrm{mol}$,$n(\mathrm{H_2})=(52.4 - 2x - 2y)\mathrm{mol}$,$n(\mathrm{MG})=(x - y)\mathrm{mol}$,$n(\mathrm{HOCH_2CH_2OH})=y\mathrm{mol}$,$n(\mathrm{CH_3OH})=(x + y)\mathrm{mol}$,根据A点DMO的转化率为80%可知$x = 0.8$;根据A点乙二醇和MG的选择性均为50%可知二者物质的量相同,即$x - y = y$,将$x = 0.8$代入得$y = 0.4$,则$n(\mathrm{DMO})=0.2\mathrm{mol}$,A点时,$n(\mathrm{H_2})=50\mathrm{mol}$,$n(\mathrm{MG})=0\mathrm{mol}$,$n(\mathrm{HOCH_2CH_2OH})=0.4\mathrm{mol}$,$n(\mathrm{CH_3OH})=1.2\mathrm{mol}$,$n_总=52.2\mathrm{mol}$,故题给反应的$Q_x=\frac{x(\mathrm{HOCH_2CH_2OH})· x(\mathrm{CH_3OH})}{x(\mathrm{MG})· x^2(\mathrm{H_2})}=\frac{n(\mathrm{HOCH_2CH_2OH})}{n_总}·\frac{n(\mathrm{CH_3OH})}{n_总·(\frac{n_总}{n_总})^2}=\frac{0.4}{52.2}×\frac{1.2}{52.2}×(\frac{50}{52.2})^{-2}\approx0.025$[另解:设起始
查看更多完整答案,请扫码查看


