2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2025·北京卷节选)通过 MgCl₂和[Mg(NH₃)₆]Cl₂的相互转化可实现 NH₃的高效存储和利用。
(1)将 Mg 的基态原子最外层轨道表示式补充完整:
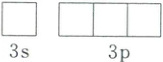
(2)NH₃分子中 H—N—H 键角小于 109°28′,从结构角度解释原因:
(3)[Mg(NH₃)₆]Cl₂的晶胞是立方体结构,边长为 a nm,结构示意图如下。
 Cl₂晶胞结构]
Cl₂晶胞结构]
①[Mg(NH₃)₆]Cl₂的配体中,配位原子是
②已知[Mg(NH₃)₆]Cl₂的摩尔质量为 M g·mol⁻¹,阿伏加德罗常数为 Nₐ,该晶体的密度为
(1)将 Mg 的基态原子最外层轨道表示式补充完整:

(2)NH₃分子中 H—N—H 键角小于 109°28′,从结构角度解释原因:
$NH_{3}$中氮原子的价层电子对数为$4$,孤电子对数为$1$;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,故$NH_{3}$分子中$H—N—H$的键角小于$109^{\circ}28'$。
。(3)[Mg(NH₃)₆]Cl₂的晶胞是立方体结构,边长为 a nm,结构示意图如下。
 Cl₂晶胞结构]
Cl₂晶胞结构]①[Mg(NH₃)₆]Cl₂的配体中,配位原子是
$N$
。②已知[Mg(NH₃)₆]Cl₂的摩尔质量为 M g·mol⁻¹,阿伏加德罗常数为 Nₐ,该晶体的密度为
$\frac{4M}{a^{3}N_{A}}×10^{21}$
g·cm⁻³。(1 nm = 10⁻⁷ cm)
答案:
3.答案:
(1)
3s 3p
↑↓ □□□
(2)$NH_{3}$中氮原子的价层电子对数为$4$,孤电子对数为$1$;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,故$NH_{3}$分子中$H—N—H$的键角小于$109^{\circ}28'$。
(3)①$N$ ②$\frac{4M}{a^{3}N_{A}}×10^{21}$
解析:
(1)$Mg$是第$12$号元素,其基态最外层电子排布式为$3s^{2}$,故其基态原子最外层轨道表示式为:
3s 3p
↑↓ □□□
(2)$NH_{3}$中氮原子的价层电子对数为$4$,孤电子对数为$1$;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,故$NH_{3}$分子中$H—N—H$的键角小于$109^{\circ}28'$。
(3)①$[Mg(NH_{3})_{6}]Cl_{2}$的内界为$[Mg(NH_{3})_{6}]^{2+}$,故其配体为$NH_{3}$,由于$N$原子有孤电子对,所以配位原子为$N$;②根据均摊法,该晶胞中$[Mg(NH_{3})_{6}]^{2+}$的个数为$8×\frac{1}{8}+6×\frac{1}{2}+1=4$,$Cl^{-}$的个数为$8$,故每个晶胞中含有$4$个$[Mg(NH_{3})_{6}]Cl_{2}$,则晶体的密度为$\rho=\frac{m_{晶胞}}{V_{晶胞}}=\frac{\frac{4M}{N_{A}} g}{(a×10^{-7})^{3} cm^{3}}=\frac{4M}{a^{3}N_{A}}×10^{21} g·cm^{-3}$。
(1)
3s 3p
↑↓ □□□
(2)$NH_{3}$中氮原子的价层电子对数为$4$,孤电子对数为$1$;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,故$NH_{3}$分子中$H—N—H$的键角小于$109^{\circ}28'$。
(3)①$N$ ②$\frac{4M}{a^{3}N_{A}}×10^{21}$
解析:
(1)$Mg$是第$12$号元素,其基态最外层电子排布式为$3s^{2}$,故其基态原子最外层轨道表示式为:
3s 3p
↑↓ □□□
(2)$NH_{3}$中氮原子的价层电子对数为$4$,孤电子对数为$1$;孤电子对对成键电子对的排斥能力大于成键电子对对成键电子对的排斥能力,故$NH_{3}$分子中$H—N—H$的键角小于$109^{\circ}28'$。
(3)①$[Mg(NH_{3})_{6}]Cl_{2}$的内界为$[Mg(NH_{3})_{6}]^{2+}$,故其配体为$NH_{3}$,由于$N$原子有孤电子对,所以配位原子为$N$;②根据均摊法,该晶胞中$[Mg(NH_{3})_{6}]^{2+}$的个数为$8×\frac{1}{8}+6×\frac{1}{2}+1=4$,$Cl^{-}$的个数为$8$,故每个晶胞中含有$4$个$[Mg(NH_{3})_{6}]Cl_{2}$,则晶体的密度为$\rho=\frac{m_{晶胞}}{V_{晶胞}}=\frac{\frac{4M}{N_{A}} g}{(a×10^{-7})^{3} cm^{3}}=\frac{4M}{a^{3}N_{A}}×10^{21} g·cm^{-3}$。
4. (2025·山东卷)Fe 单质及其化合物应用广泛。回答下列问题:
(1)在元素周期表中,Fe 位于第
(2)尿素分子(H₂NCONH₂)与 Fe³⁺形成配离子的硝酸盐[Fe(H₂NCONH₂)₆](NO₃)₃俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素 C、N、O 中,第一电离能最大的是
②尿素分子中,C 原子采取的轨道杂化方式为
③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中 Fe³⁺的配位数为 6,碳氮键的键长均相等,则与 Fe³⁺配位的原子是
(3)α-Fe 可用作合成氨催化剂,其体心立方晶胞如图所示(晶胞边长为 a pm)。
①α-Fe 晶胞中 Fe 原子的半径为
②研究发现,α-Fe 晶胞中阴影所示 m、n 两个截面的催化活性不同,截面单位面积含有 Fe 原子个数越多,催化活性越低。m、n 截面中,催化活性较低的是
 ]
]
(1)在元素周期表中,Fe 位于第
四
周期Ⅷ
族。基态 Fe 原子与基态 Fe³⁺离子未成对电子数之比为$4:5$
。(2)尿素分子(H₂NCONH₂)与 Fe³⁺形成配离子的硝酸盐[Fe(H₂NCONH₂)₆](NO₃)₃俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素 C、N、O 中,第一电离能最大的是
$N$
,电负性最大的是$O$
。②尿素分子中,C 原子采取的轨道杂化方式为
$sp^{2}$
。③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中 Fe³⁺的配位数为 6,碳氮键的键长均相等,则与 Fe³⁺配位的原子是
$O$
(填元素符号)。(3)α-Fe 可用作合成氨催化剂,其体心立方晶胞如图所示(晶胞边长为 a pm)。
①α-Fe 晶胞中 Fe 原子的半径为
$\frac{\sqrt{3}}{4}a$
pm。②研究发现,α-Fe 晶胞中阴影所示 m、n 两个截面的催化活性不同,截面单位面积含有 Fe 原子个数越多,催化活性越低。m、n 截面中,催化活性较低的是
$n$
,该截面单位面积含有的 Fe 原子为$\frac{\sqrt{2}}{a^{2}}$
个·pm⁻²。 ]
]
答案:
4.答案:
(1)四 Ⅷ $4:5$
(2)①$N$ O ②$sp^{2}$ ③O
(3)①$\frac{\sqrt{3}}{4}a$ ②$n$ $\frac{\sqrt{2}}{a^{2}}$
解析:
(1)$Fe$为$26$号元素,基态$Fe$原子的价电子排布式为$3d^{6}4s^{2}$,故$Fe$位于第四周期Ⅷ族。基态$Fe$原子、基态$Fe^{3+}$的价电子排布式分别为$3d^{6}4s^{2}$、$3d^{5}$,未成对电子数之比为$4:5$。
(2)①同周期元素从左到右第一电离能呈增大趋势,$N$由于$2p$能级为半充满状态,较稳定,其第一电离能大于$O$,故元素$C$、$N$、$O$中,第一电离能最大的是$N$;同周期元素从左到右电负性逐渐增大,故元素$C$、$N$、$O$中,电负性最大的是$O$。②尿素分子中,$C$原子形成$1$个双键、$2$个单键,无孤电子对,故$C$原子采取的轨道杂化方式为$sp^{2}$。③八面体配位离子$[Fe(H_{2}NCONH_{2})_{6}]^{3+}$中$Fe^{3+}$的配位数为$6$,则形成$6$个配位键,$H_{2}NCONH_{2}$中$O$和$N$上有孤对电子,能与$Fe^{3+}$形成配位键,由碳氮键的键长均相等,知配位原子不能是$N$,故与$Fe^{3+}$配位的原子是$O$。
(3)①$\alpha-Fe$晶胞为体心立方晶胞,体对角线上$3$个$Fe$原子相切,设$Fe$原子半径为$r$,则$4r=\sqrt{3}a pm$,解得$r=\frac{\sqrt{3}}{4}a pm$。②$m$截面中$Fe$的个数为$4×\frac{1}{4}=1$,面积为$a^{2} pm^{2}$,则单位面积含有的$Fe$原子个数为$\frac{1}{a^{2}}$;$n$截面中$Fe$的个数为$4×\frac{1}{4}+1=2$,面积为$\sqrt{2}a^{2} pm^{2}$,则单位面积含有的$Fe$原子个数为$\frac{\sqrt{2}}{a^{2}}$,故催化活性较低的是$n$。
(1)四 Ⅷ $4:5$
(2)①$N$ O ②$sp^{2}$ ③O
(3)①$\frac{\sqrt{3}}{4}a$ ②$n$ $\frac{\sqrt{2}}{a^{2}}$
解析:
(1)$Fe$为$26$号元素,基态$Fe$原子的价电子排布式为$3d^{6}4s^{2}$,故$Fe$位于第四周期Ⅷ族。基态$Fe$原子、基态$Fe^{3+}$的价电子排布式分别为$3d^{6}4s^{2}$、$3d^{5}$,未成对电子数之比为$4:5$。
(2)①同周期元素从左到右第一电离能呈增大趋势,$N$由于$2p$能级为半充满状态,较稳定,其第一电离能大于$O$,故元素$C$、$N$、$O$中,第一电离能最大的是$N$;同周期元素从左到右电负性逐渐增大,故元素$C$、$N$、$O$中,电负性最大的是$O$。②尿素分子中,$C$原子形成$1$个双键、$2$个单键,无孤电子对,故$C$原子采取的轨道杂化方式为$sp^{2}$。③八面体配位离子$[Fe(H_{2}NCONH_{2})_{6}]^{3+}$中$Fe^{3+}$的配位数为$6$,则形成$6$个配位键,$H_{2}NCONH_{2}$中$O$和$N$上有孤对电子,能与$Fe^{3+}$形成配位键,由碳氮键的键长均相等,知配位原子不能是$N$,故与$Fe^{3+}$配位的原子是$O$。
(3)①$\alpha-Fe$晶胞为体心立方晶胞,体对角线上$3$个$Fe$原子相切,设$Fe$原子半径为$r$,则$4r=\sqrt{3}a pm$,解得$r=\frac{\sqrt{3}}{4}a pm$。②$m$截面中$Fe$的个数为$4×\frac{1}{4}=1$,面积为$a^{2} pm^{2}$,则单位面积含有的$Fe$原子个数为$\frac{1}{a^{2}}$;$n$截面中$Fe$的个数为$4×\frac{1}{4}+1=2$,面积为$\sqrt{2}a^{2} pm^{2}$,则单位面积含有的$Fe$原子个数为$\frac{\sqrt{2}}{a^{2}}$,故催化活性较低的是$n$。
查看更多完整答案,请扫码查看


