2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
[例题分析] (2024·湖北卷)我国科学家设计了一种双位点PbCu电催化剂,用H$_2$C$_2$O$_4$和NH$_2$OH电化学催化合成甘氨酸,原理如图,双极膜中H$_2$O解离的H⁺和OH⁻在电场作用下向两极迁移。已知在KOH溶液中,甲醛转化为HOCH$_2$O⁻,存在平衡HOCH$_2$O⁻ + OH⁻ $\rightleftharpoons$ [OCH$_2$O]$^{2-}$ + H$_2$O。Cu电极上发生的电子转移反应为[OCH$_2$O]$^{2-}$ - e$^-$ = HCOO⁻ + H·。下列说法错误的是()

A.电解一段时间后阳极区c(OH⁻)减小
B.理论上生成1 mol H$_3$N⁺CH$_2$COOH双极膜中有4 mol H$_2$O解离
C.阳极总反应式为2HCHO + 4OH⁻ - 2e$^-$= 2HCOO⁻ + H$_2$↑ + 2H$_2$O
D.阴极区存在反应H$_2$C$_2$O$_4$ + 2H⁺ + 2e$^-$ = CHOCOOH + H$_2$O

A.电解一段时间后阳极区c(OH⁻)减小
B.理论上生成1 mol H$_3$N⁺CH$_2$COOH双极膜中有4 mol H$_2$O解离
C.阳极总反应式为2HCHO + 4OH⁻ - 2e$^-$= 2HCOO⁻ + H$_2$↑ + 2H$_2$O
D.阴极区存在反应H$_2$C$_2$O$_4$ + 2H⁺ + 2e$^-$ = CHOCOOH + H$_2$O
答案:
[例题分析] B 根据题干信息可知,Cu电极所在的阳极区先后发生反应:HCHO + OH⁻⇌HOCH₂O⁻
HOCH₂O⁻ + OH⁻⇌[OCH₂O]²⁻ + H₂O
[OCH₂O]²⁻ - e⁻ = HCOO⁻ + H·,H⁺可转化为H₂,则阳极总反应式为2HCHO + 4OH⁻ - 2e⁻ = 2HCOO⁻ + H₂↑ + 2H₂O,C正确;根据阳极总反应可知,每消耗4个OH⁻,电路中通过2e⁻,根据电荷守恒,双极膜中有2个OH⁻向阳极迁移,即阳极区c(OH⁻)减小,A正确;由题给信息知,阴极总反应物为H₂C₂O₄、NH₂OH,总产物为H₃N⁺CH₂COOH,电极反应式为H₂C₂O₄ + NH₂OH + 6e⁻ + 7H⁺ = H₃N⁺CH₂COOH + 3H₂O,每生成1molH₃N⁺CH₂COOH,电路中通过6mole⁻,双极膜中需有6molH₂O解离出6molH⁺向阴极迁移,B错误;双极膜中H₂O解离出的H⁺向阴极移动,H₂C₂O₄在阴极Pb电极上转化为OHCCOOH的反应为H₂C₂O₄ + 2H⁺ + 2e⁻ = OHCCOOH + H₂O,D正确。
HOCH₂O⁻ + OH⁻⇌[OCH₂O]²⁻ + H₂O
[OCH₂O]²⁻ - e⁻ = HCOO⁻ + H·,H⁺可转化为H₂,则阳极总反应式为2HCHO + 4OH⁻ - 2e⁻ = 2HCOO⁻ + H₂↑ + 2H₂O,C正确;根据阳极总反应可知,每消耗4个OH⁻,电路中通过2e⁻,根据电荷守恒,双极膜中有2个OH⁻向阳极迁移,即阳极区c(OH⁻)减小,A正确;由题给信息知,阴极总反应物为H₂C₂O₄、NH₂OH,总产物为H₃N⁺CH₂COOH,电极反应式为H₂C₂O₄ + NH₂OH + 6e⁻ + 7H⁺ = H₃N⁺CH₂COOH + 3H₂O,每生成1molH₃N⁺CH₂COOH,电路中通过6mole⁻,双极膜中需有6molH₂O解离出6molH⁺向阴极迁移,B错误;双极膜中H₂O解离出的H⁺向阴极移动,H₂C₂O₄在阴极Pb电极上转化为OHCCOOH的反应为H₂C₂O₄ + 2H⁺ + 2e⁻ = OHCCOOH + H₂O,D正确。
1. (2025·白山二模)大连理工大学提出了一种低能耗、无阳极氯腐蚀的电解混合海水制氢新技术,如图所示。下列叙述错误的是(
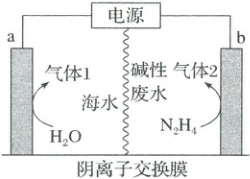
A.在该条件下,N$_2$H$_4$的放电能力强于Cl⁻
B.a极与电源负极连接,发生氧化反应产生O$_2$
C.b极反应式为N$_2$H$_4$ + 4OH⁻ - 4e$^-$ = N$_2$↑ + 4H$_2$O
D.逸出2.24 L气体1(标准状况)时外电路转移电子数为0.2$N_A$
B
)
A.在该条件下,N$_2$H$_4$的放电能力强于Cl⁻
B.a极与电源负极连接,发生氧化反应产生O$_2$
C.b极反应式为N$_2$H$_4$ + 4OH⁻ - 4e$^-$ = N$_2$↑ + 4H$_2$O
D.逸出2.24 L气体1(标准状况)时外电路转移电子数为0.2$N_A$
答案:
1.B 由题干信息可知,无阳极氯腐蚀,故在该条件下,N₂H₄的放电能力强于Cl⁻,Cl⁻不放电,N₂H₄发生氧化反应生成N₂,A正确;由题可知,该电解池采用电解制氢新技术,结合A选项中分析,b极为阳极,则a极为阴极,与电源负极连接,气体1为H₂,发生还原反应:2H₂O + 2e⁻ = 2OH⁻ + H₂↑,B错误;b极为阳极,N₂H₄发生氧化反应生成N₂,电极反应式正确,C正确;a极电极反应式为2H₂O + 2e⁻ = 2OH⁻ + H₂↑,根据电极反应式知,标准状况下,产生0.1molH₂时外电路转移电子数为0.2N_A,D正确。
查看更多完整答案,请扫码查看


