2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·河南卷)某研究小组设计了如下实验测定某药用硫黄中硫的含量,其中硫转化的总反应为$S+2OH^{-}+3H_{2}O_{2}=SO_{4}^{2 - }+4H_{2}O$。
主要实验步骤如下:
Ⅰ. 如图所示,准确称取$m\ g$细粉状药用硫黄于①中,并准确加入$V_{1}\ mL\ KOH$乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。
Ⅱ. 室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量$30\%\ H_{2}O_{2}$溶液,加热至$100\ ^{\circ}C$,保持$20\ min$,冷却至室温。
Ⅲ. 将①中溶液全部转移至锥形瓶中,加入$2$滴甲基橙指示剂,用$c\ mol·L^{-1}\ HCl$标准溶液滴定至终点,消耗$HCl$溶液体积为$V_{2}\ mL$。
Ⅳ. 不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_{3}\ mL$。计算样品中硫的质量分数。
Ⅴ. 平行测定三次,计算硫含量的平均值。
回答下列问题:
(1) 仪器①的名称是
(2) 步骤Ⅰ中,乙醇的作用是________。
(3) 步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是________。
(4) 步骤Ⅱ中不宜采用水浴加热的原因是________。步骤Ⅱ结束后,若要检验反应后溶液中的$SO_{4}^{2 - }$,实验操作是________。
(5) 步骤Ⅲ中,判断滴定达到终点的现象为________。
(6) 单次样品测定中硫的质量分数可表示为________(写出计算式)。

主要实验步骤如下:
Ⅰ. 如图所示,准确称取$m\ g$细粉状药用硫黄于①中,并准确加入$V_{1}\ mL\ KOH$乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。
Ⅱ. 室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量$30\%\ H_{2}O_{2}$溶液,加热至$100\ ^{\circ}C$,保持$20\ min$,冷却至室温。
Ⅲ. 将①中溶液全部转移至锥形瓶中,加入$2$滴甲基橙指示剂,用$c\ mol·L^{-1}\ HCl$标准溶液滴定至终点,消耗$HCl$溶液体积为$V_{2}\ mL$。
Ⅳ. 不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_{3}\ mL$。计算样品中硫的质量分数。
Ⅴ. 平行测定三次,计算硫含量的平均值。
回答下列问题:
(1) 仪器①的名称是
圆底烧瓶
;②的名称是球形冷凝管
。(2) 步骤Ⅰ中,乙醇的作用是________。
(3) 步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是________。
(4) 步骤Ⅱ中不宜采用水浴加热的原因是________。步骤Ⅱ结束后,若要检验反应后溶液中的$SO_{4}^{2 - }$,实验操作是________。
(5) 步骤Ⅲ中,判断滴定达到终点的现象为________。
(6) 单次样品测定中硫的质量分数可表示为________(写出计算式)。

答案:
2.
(1)圆底烧瓶 球形冷凝管
(2)作溶剂,溶解硫黄
(3)防止乙醇被过氧化氢氧化,干扰后续滴定
(4)水浴加热不能持续保持$100^{\circ}C$ 取少量溶液于试管中,先加入$HCl$酸化,再加入氯化钡溶液,若有白色沉淀生成,则溶液中含有$SO_4^{2-}$,反之不含$SO_4^{2-}$
(5)加入最后半滴$HCl$标准溶液,溶液恰好由黄色变为橙色,且半分钟内颜色不恢复
(6)$\frac{16c(V_3 - V_2)×10^{-3}}{m}×100\%$
解析:
(1)由图中仪器构造特点可知,仪器①的名称是圆底烧瓶,仪器②的名称是球形冷凝管。
(2)由于$S$难溶于水,微溶于乙醇,故步骤Ⅰ中,乙醇的作用是作溶剂,溶解硫黄。
(3)由于过氧化氢能将乙醇氧化,干扰后续滴定,故步骤Ⅰ中,样品完全溶解后必须蒸馏除去乙醇。
(4)由于水浴加热不能持续保持$100^{\circ}C$,故步骤Ⅱ中不宜采用水浴加热。步骤Ⅱ结束后,若要检验反应后溶液中的$SO_4^{2-}$,实验操作是取少量溶液于试管中,先加入$HCl$酸化,再加入氯化钡溶液,若有白色沉淀生成,则溶液中含有$SO_4^{2-}$,反之不含$SO_4^{2-}$。
(5)步骤Ⅲ中是用盐酸标准溶液滴定溶液中过量的碱,指示剂为甲基橙,故判断滴定达到终点的现象为加入最后半滴$HCl$标准溶液,溶液恰好由黄色变为橙色,且半分钟内颜色不恢复。
(6)不加入硫黄进行步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_3mL$,由此可知,起始加入的$n(KOH)=cV_3×10^{-3}mol$。加入硫黄进行步骤Ⅰ、Ⅱ、Ⅲ操作,用$c mol· L^{-1}HCl$标准溶液滴定至终点,消耗$HCl$标准溶液体积为$V_2mL$,由此可知,与$S$反应后剩余的$KOH$的物质的量为$cV_2×10^{-3}mol$,故与单质硫反应消耗的$KOH$的物质的量为$c(V_3 - V_2)×10^{-3}mol$,结合题中所给的离子方程式可知,样品中硫的物质的量为$\frac{c(V_3 - V_2)×10^{-3}}{2}mol$,故单次样品测定中硫的质量分数可表示为$\frac{16c(V_3 - V_2)×10^{-3}}{m}×100\%$。
(1)圆底烧瓶 球形冷凝管
(2)作溶剂,溶解硫黄
(3)防止乙醇被过氧化氢氧化,干扰后续滴定
(4)水浴加热不能持续保持$100^{\circ}C$ 取少量溶液于试管中,先加入$HCl$酸化,再加入氯化钡溶液,若有白色沉淀生成,则溶液中含有$SO_4^{2-}$,反之不含$SO_4^{2-}$
(5)加入最后半滴$HCl$标准溶液,溶液恰好由黄色变为橙色,且半分钟内颜色不恢复
(6)$\frac{16c(V_3 - V_2)×10^{-3}}{m}×100\%$
解析:
(1)由图中仪器构造特点可知,仪器①的名称是圆底烧瓶,仪器②的名称是球形冷凝管。
(2)由于$S$难溶于水,微溶于乙醇,故步骤Ⅰ中,乙醇的作用是作溶剂,溶解硫黄。
(3)由于过氧化氢能将乙醇氧化,干扰后续滴定,故步骤Ⅰ中,样品完全溶解后必须蒸馏除去乙醇。
(4)由于水浴加热不能持续保持$100^{\circ}C$,故步骤Ⅱ中不宜采用水浴加热。步骤Ⅱ结束后,若要检验反应后溶液中的$SO_4^{2-}$,实验操作是取少量溶液于试管中,先加入$HCl$酸化,再加入氯化钡溶液,若有白色沉淀生成,则溶液中含有$SO_4^{2-}$,反之不含$SO_4^{2-}$。
(5)步骤Ⅲ中是用盐酸标准溶液滴定溶液中过量的碱,指示剂为甲基橙,故判断滴定达到终点的现象为加入最后半滴$HCl$标准溶液,溶液恰好由黄色变为橙色,且半分钟内颜色不恢复。
(6)不加入硫黄进行步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_3mL$,由此可知,起始加入的$n(KOH)=cV_3×10^{-3}mol$。加入硫黄进行步骤Ⅰ、Ⅱ、Ⅲ操作,用$c mol· L^{-1}HCl$标准溶液滴定至终点,消耗$HCl$标准溶液体积为$V_2mL$,由此可知,与$S$反应后剩余的$KOH$的物质的量为$cV_2×10^{-3}mol$,故与单质硫反应消耗的$KOH$的物质的量为$c(V_3 - V_2)×10^{-3}mol$,结合题中所给的离子方程式可知,样品中硫的物质的量为$\frac{c(V_3 - V_2)×10^{-3}}{2}mol$,故单次样品测定中硫的质量分数可表示为$\frac{16c(V_3 - V_2)×10^{-3}}{m}×100\%$。
3. (2025·云南卷)三氟甲基亚磺酸锂$(M_{r}=140)$是我国科学家通过人工智能设计开发的一种锂离子电池补锂剂,其合成原理如下:

$F_{3}C-S-Cl+Na_{2}SO_{3}\xrightarrow{NaHCO_{3},80\ ^{\circ}C}F_{3}C-S-ONa\xrightarrow{HCl,THF}M\xrightarrow{LiOH,H_{2}O}F_{3}C-S-OLi$
实验步骤如下:
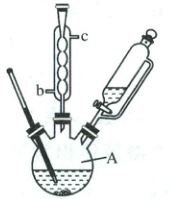
Ⅰ. 向$A$中加入$3.5\ g\ NaHCO_{3}$、$5.2\ g\ Na_{2}SO_{3}$和$20.0\ mL$蒸馏水,搅拌下逐滴加入$2.1\ mL$($3.3\ g$)三氟甲磺酰氯$(M_{r}=168.5)$,有气泡产生(装置如图,夹持及加热装置省略)。$80\ ^{\circ}C$下反应$3\ h$后,减压蒸除溶剂得浅黄色固体。
Ⅱ. 向上述所得固体中加入$10.0\ mL$四氢呋喃($THF$),充分搅拌后,加入无水$Na_{2}SO_{4}$,振荡,抽滤、洗涤。将所得滤液减压蒸除$THF$,得黏稠状固体。加入适量乙醇进行重结晶。
Ⅲ. 将所得三氟甲基亚磺酸钠和$3.0\ mL\ THF$加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,析出白色固体。抽滤、洗涤。
Ⅳ. 将滤液转入圆底烧瓶中,加入$2.0\ mL$蒸馏水和过量$LiOH$。室温搅拌反应$1\ h$后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品$1.1\ g$。
已知:$THF$是一种有机溶剂,与水任意比互溶。
回答下列问题:
(1) 仪器$A$的名称为
(2) 步骤Ⅰ反应中有气泡产生,其主要成分为
(3) 步骤Ⅱ中第一次洗涤的目的是________。
(4) 步骤Ⅲ中发生反应的化学方程式为________,判断加入浓盐酸已足量的方法为________。
(5) 步骤Ⅳ中加入蒸馏水的作用是
(6) 三氟甲基亚磺酸锂的产率为

$F_{3}C-S-Cl+Na_{2}SO_{3}\xrightarrow{NaHCO_{3},80\ ^{\circ}C}F_{3}C-S-ONa\xrightarrow{HCl,THF}M\xrightarrow{LiOH,H_{2}O}F_{3}C-S-OLi$
实验步骤如下:
Ⅰ. 向$A$中加入$3.5\ g\ NaHCO_{3}$、$5.2\ g\ Na_{2}SO_{3}$和$20.0\ mL$蒸馏水,搅拌下逐滴加入$2.1\ mL$($3.3\ g$)三氟甲磺酰氯$(M_{r}=168.5)$,有气泡产生(装置如图,夹持及加热装置省略)。$80\ ^{\circ}C$下反应$3\ h$后,减压蒸除溶剂得浅黄色固体。

Ⅱ. 向上述所得固体中加入$10.0\ mL$四氢呋喃($THF$),充分搅拌后,加入无水$Na_{2}SO_{4}$,振荡,抽滤、洗涤。将所得滤液减压蒸除$THF$,得黏稠状固体。加入适量乙醇进行重结晶。
Ⅲ. 将所得三氟甲基亚磺酸钠和$3.0\ mL\ THF$加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,析出白色固体。抽滤、洗涤。
Ⅳ. 将滤液转入圆底烧瓶中,加入$2.0\ mL$蒸馏水和过量$LiOH$。室温搅拌反应$1\ h$后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品$1.1\ g$。
已知:$THF$是一种有机溶剂,与水任意比互溶。
回答下列问题:
(1) 仪器$A$的名称为
三颈烧瓶
,冷凝管中冷却水应从b
(填“$b$”或“$c$”)口通入。(2) 步骤Ⅰ反应中有气泡产生,其主要成分为
二氧化碳
。(3) 步骤Ⅱ中第一次洗涤的目的是________。
(4) 步骤Ⅲ中发生反应的化学方程式为________,判断加入浓盐酸已足量的方法为________。
(5) 步骤Ⅳ中加入蒸馏水的作用是
作为溶剂,溶解后加快反应速率
。(6) 三氟甲基亚磺酸锂的产率为
40%
。
答案:
3.
(1)三颈烧瓶 b
(2)二氧化碳
(3)将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率
(4)$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$
取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量
(5)作为溶剂,溶解后加快反应速率
(6)40%
解析:
(1)由图可知,A为三颈烧瓶,中间为冷凝管,为了提高冷凝效果,冷却水从b口通入,c口流出,故答案为:三颈烧瓶;b;
(2)向A中加入$3.5gNaHCO_3$、$5.2gNa_2SO_3$和$20.0mL$蒸馏水,搅拌下逐滴加入$2.1mL(3.3g)$三氟甲磺酰氯($Mr = 168.5$),生成了三氟甲基亚磺酸钠、硫酸钠和氯化氢,碳酸氢钠与氯化氢反应生成二氧化碳,所以有气泡产生,故答案为:二氧化碳;
(3)A中反应生成了三氟甲基亚磺酸钠、硫酸钠和氯化氢等,上述所得固体中加入$10.0mL$四氢呋喃(THF),充分搅拌后,加入无水$Na_2SO_4$,可促进硫酸钠结晶析出,振荡,抽滤除去硫酸钠等固体、洗涤,洗涤可将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率,故答案为:将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率;
(4)由分析可知,将所得三氟甲基亚磺酸钠和$3.0mLTHF$加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,发生的化学方程式为:$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$,析出白色固体,所以判断加入盐酸已足量的方法为:取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量,故答案为:$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$;取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量;
(5)将滤液转入圆底烧瓶中,加入$2.0mL$蒸馏水和过量$LiOH$,水可作为溶剂,溶解后加快反应速率,故答案为:作为溶剂,溶解后加快反应速率;
(6)已知向A中加入$3.5gNaHCO_3$、$5.2gNa_2SO_3$和$2.1mL(3.3g)$三氟甲磺酰氯($Mr = 168.5$),三氟甲磺酰氯量不足,以三氟甲磺酰氯计算理论产量为:$\frac{140×3.3}{168}g = 2.75g$,氟甲基亚磺酸锂的产率为$\frac{1.1g}{2.75g}×100\% = 40\%$,故答案为:40%。
(1)三颈烧瓶 b
(2)二氧化碳
(3)将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率
(4)$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$
取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量
(5)作为溶剂,溶解后加快反应速率
(6)40%
解析:
(1)由图可知,A为三颈烧瓶,中间为冷凝管,为了提高冷凝效果,冷却水从b口通入,c口流出,故答案为:三颈烧瓶;b;
(2)向A中加入$3.5gNaHCO_3$、$5.2gNa_2SO_3$和$20.0mL$蒸馏水,搅拌下逐滴加入$2.1mL(3.3g)$三氟甲磺酰氯($Mr = 168.5$),生成了三氟甲基亚磺酸钠、硫酸钠和氯化氢,碳酸氢钠与氯化氢反应生成二氧化碳,所以有气泡产生,故答案为:二氧化碳;
(3)A中反应生成了三氟甲基亚磺酸钠、硫酸钠和氯化氢等,上述所得固体中加入$10.0mL$四氢呋喃(THF),充分搅拌后,加入无水$Na_2SO_4$,可促进硫酸钠结晶析出,振荡,抽滤除去硫酸钠等固体、洗涤,洗涤可将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率,故答案为:将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率;
(4)由分析可知,将所得三氟甲基亚磺酸钠和$3.0mLTHF$加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,发生的化学方程式为:$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$,析出白色固体,所以判断加入盐酸已足量的方法为:取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量,故答案为:$F_3CSONa + HCl\xrightarrow{THF}F_3CSOH + NaCl$;取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量;
(5)将滤液转入圆底烧瓶中,加入$2.0mL$蒸馏水和过量$LiOH$,水可作为溶剂,溶解后加快反应速率,故答案为:作为溶剂,溶解后加快反应速率;
(6)已知向A中加入$3.5gNaHCO_3$、$5.2gNa_2SO_3$和$2.1mL(3.3g)$三氟甲磺酰氯($Mr = 168.5$),三氟甲磺酰氯量不足,以三氟甲磺酰氯计算理论产量为:$\frac{140×3.3}{168}g = 2.75g$,氟甲基亚磺酸锂的产率为$\frac{1.1g}{2.75g}×100\% = 40\%$,故答案为:40%。
查看更多完整答案,请扫码查看


