2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1.(2025·湖北三模)一种新型电池的工作原理如图所示,其中电极材料均为石墨,阴离子交换膜只允许$SO_4^{2-}$通过,工作时两极室均无气体生成。下列说法错误的是(
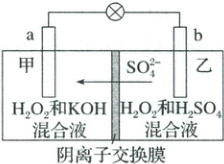
A.电极a为负极
B.工作时乙室溶液pH减小
C.该电池的总反应为$H^+ + OH^- \longrightarrow H_2O$
D.每转移$1\ mol\ e^-$时甲室质量增加$48\ g$
B
)
A.电极a为负极
B.工作时乙室溶液pH减小
C.该电池的总反应为$H^+ + OH^- \longrightarrow H_2O$
D.每转移$1\ mol\ e^-$时甲室质量增加$48\ g$
答案:
1.B 根据$SO_4^{2-}$移动方向可知$a$极为负极,A正确;$b$极为正极,发生反应$H_2O_2 + 2H^+ + 2e^- = 2H_2O$,电池工作时乙室溶液$pH$增大,B错误;该电池的总反应为$H^+ + OH^- = H_2O$,C正确;甲室发生反应$2OH^- - 2e^- = H_2O_2$,电池工作时每转移$1\ mol\ e^-$,甲室迁移进入$0.5\ mol\ SO_4^{2-}$,质量增加$48\ g$,D正确。
2.(2025·河南二模)一种室内甲醛传感器测量甲醛含量的工作原理如图所示。
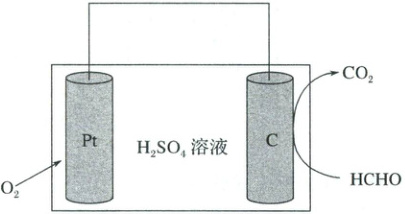
已知:国家标准是室内甲醛含量不超过$0.080\ mg·m^{-3}$下列说法错误的是(
A.$Pt$电极电势高于$C$电极电势
B.负极电极反应式为$HCHO + H_2O - 4e^- \longrightarrow CO_2 + 4H^+$
C.$H_2SO_4$溶液为离子导体
D.传感器在$27\ m^3$室内空间测定时,电路中转移$5.4×10^{-4}\ mol\ e^-$,该室内甲醛含量符合国家标准

已知:国家标准是室内甲醛含量不超过$0.080\ mg·m^{-3}$下列说法错误的是(
D
)A.$Pt$电极电势高于$C$电极电势
B.负极电极反应式为$HCHO + H_2O - 4e^- \longrightarrow CO_2 + 4H^+$
C.$H_2SO_4$溶液为离子导体
D.传感器在$27\ m^3$室内空间测定时,电路中转移$5.4×10^{-4}\ mol\ e^-$,该室内甲醛含量符合国家标准
答案:
2.D 在$Pt$电极上氧气放电,发生还原反应,故$Pt$电极为正极;石墨电极甲醛被氧化生成二氧化碳,做负极,电极反应式为$HCHO+H_2O-4e^-=CO_2 + 4H^+$。$HCHO$中$C$元素化合价升高,发生氧化反应,$C$电极为原电池的负极,$Pt$电极为正极,正极的电势高于负极的电势,A项正确;$1\ mol\ HCHO$失去$4\ mol$电子生成二氧化碳,负极电极反应式为$HCHO+H_2O-4e^-=CO_2 + 4H^+$,B项正确;导体分为离子导体和电子导体,电解质溶液或熔融的电解质为离子导体,C项正确;传感器在$27\ m^3$室内空间测定时,电路中转移$5.4 × 10^{-4}\ mol$电子,该室内甲醛含量为$\frac{\frac{1}{4} × 5.4 × 10^{-4}\ mol × 30 × 10^3\ mg · mol^{-1}}{27\ m^3}=0.15\ mg · m^{-3}>0.08\ mg · m^{-3}$,该室内甲醛含量超出国家标准,D项错误;故选D。
3.(2025·山东名校大联考4月联合检测)二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,其装置示意图如图所示:
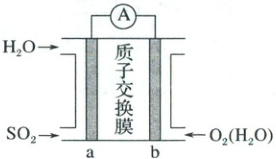
下列说法错误的是(
A.电池工作时,质子由a极移向b极
B.b为电池正极
C.a极反应式为$SO_2 - 2e^- + H_2O \longrightarrow SO_4^{2-} + 2H^+$
D.理论上每吸收$1\ mol\ SO_2$,b电极消耗的$O_2$的体积为$11.2\ L$(标准状况)

下列说法错误的是(
C
)A.电池工作时,质子由a极移向b极
B.b为电池正极
C.a极反应式为$SO_2 - 2e^- + H_2O \longrightarrow SO_4^{2-} + 2H^+$
D.理论上每吸收$1\ mol\ SO_2$,b电极消耗的$O_2$的体积为$11.2\ L$(标准状况)
答案:
3.C 由图可知,电极$a$为燃料电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸根离子和氢离子,电极$b$为正极,酸性条件下氧气在正极得到电子发生还原反应生成水。由分析可知,电极$a$为燃料电池的负极,电极$b$为正极,故A正确;由分析可知,电极$a$为燃料电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸根离子和氢离子,电极反应式为$SO_2 - 2e^- + 2H_2O=SO_4^{2-} + 4H^+$,故C错误;由得失电子守恒可知,理论上每吸收$1\ mol$二氧化硫,标准状况下$b$电极消耗氧气的体积为$1\ mol × \frac{2}{4} × 22.4\ L · mol^{-1}=11.2\ L$,故D正确;故选C。
1.(2025·安徽卷)研究人员开发出一种锂-氢可充电电池(如图所示),使用前需先充电,其固体电解质仅允许$Li^+$通过。下列说法正确的是(
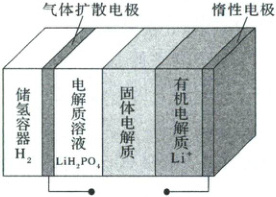
A.放电时电解质溶液质量减小
B.放电时电池总反应为$H_2 + 2Li \longrightarrow 2LiH$
C.充电时$Li^+$移向惰性电极
D.充电时每转移$1\ mol$电子,$c(H^+)$降低$1\ mol·L^{-1}$
C
)
A.放电时电解质溶液质量减小
B.放电时电池总反应为$H_2 + 2Li \longrightarrow 2LiH$
C.充电时$Li^+$移向惰性电极
D.充电时每转移$1\ mol$电子,$c(H^+)$降低$1\ mol·L^{-1}$
答案:
1.C 由放电时正极发生的反应知,每$2\ mol(14\ g)Li^+$进入电解质溶液,有$1\ mol(2\ g)H_2$扩散到储氢容器,故电解质溶液质量增加,A错误;由正、负极发生的反应知,放电时电池总反应为$2Li + 2H_3PO_4=H_2\uparrow + 2LiH_2PO_4$,B错误;电解池中阳离子移向阴极,故充电时$Li^+$移向惰性电极,C正确;电解质溶液体积未知,且$H_3PO_4$是弱酸,故$c(H^+)$变化大小不能判断,D错误。
2.(双选)(2025·山东卷)全铁液流电池工作原理如图所示,两电极分别为石墨电极和负载铁的石墨电极。下列说法正确的是(
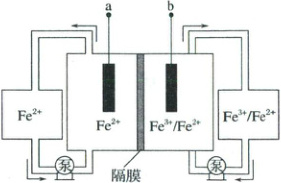
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液$Fe^{2+}$浓度均减小
D.理论上,$Fe^{3+}$每减少$1\ mol$,$Fe^{2+}$总量相应增加$2\ mol$
BC
)
A.隔膜为阳离子交换膜
B.放电时,a极为负极
C.充电时,隔膜两侧溶液$Fe^{2+}$浓度均减小
D.理论上,$Fe^{3+}$每减少$1\ mol$,$Fe^{2+}$总量相应增加$2\ mol$
答案:
2.BC 隔膜需防止右侧的$Fe^{3+}$进入左侧,应使用阴离子交换膜,A错误;由上述分析知,B正确;充电时的总反应为$3Fe^{2+}\stackrel{通电}{=}Fe + 2Fe^{3+}$,消耗$Fe^{2+}$,故隔膜两侧溶液$Fe^{2+}$浓度均减小,C正确;根据放电的总反应知,$Fe^{3+}$每减少$1\ mol$,$Fe^{2+}$总量相应增加$1.5\ mol$,D错误。
查看更多完整答案,请扫码查看


