2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2024·新课标卷)常温下${CH_{2}ClCOOH}$和${CHCl_{2}COOH}$的两种溶液中,分布系数$\delta$与$pH$的变化关系如图所示。[比如:$\delta({CH_{2}ClCOO^{-}})=\frac{c({CH_{2}ClCOO^{-}})}{c({CH_{2}ClCOOH}) + c({CH_{2}ClCOO^{-}})}$]
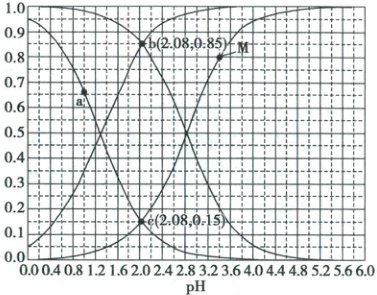
下列叙述正确的是(
A.曲线$M$表示$\delta({CHCl_{2}COO^{-}})\sim pH$的变化关系
B.若酸的初始浓度为$0.10\ mol· L^{-1}$,则$a$点对应的溶液中有$c({H^{+}}) = c({CHCl_{2}COO^{-}}) + c({OH^{-}})$
C.${CH_{2}ClCOOH}$的电离常数$K_{a} = 10^{-1.3}$
D.$pH = 2.08$时,$\frac{电离度\alpha({CH_{2}ClCOOH})}{电离度\alpha({CHCl_{2}COOH})} = \frac{0.15}{0.85}$

下列叙述正确的是(
D
)A.曲线$M$表示$\delta({CHCl_{2}COO^{-}})\sim pH$的变化关系
B.若酸的初始浓度为$0.10\ mol· L^{-1}$,则$a$点对应的溶液中有$c({H^{+}}) = c({CHCl_{2}COO^{-}}) + c({OH^{-}})$
C.${CH_{2}ClCOOH}$的电离常数$K_{a} = 10^{-1.3}$
D.$pH = 2.08$时,$\frac{电离度\alpha({CH_{2}ClCOOH})}{电离度\alpha({CHCl_{2}COOH})} = \frac{0.15}{0.85}$
答案:
3.D Cl为弱吸电子基,则$CH_2ClCOOH$的酸性弱于$CHCl_2COOH$,故$K_a(CH_2ClCOOH)<K_a(CHCl_2COOH)$。调pH时,$CHCl_2COOH$溶液中$CHCl_2COOH$分布系数减小的趋势快,$CHCl_2COO^-$分布系数增大的趋势快,$CH_2ClCOOH$溶液中$CH_2ClCOOH$分布系数减小的趋势缓慢,$CH_2ClCOO^-$分布系数增大的趋势缓慢,故曲线M表示$\delta(CH_2ClCOO^-) \sim pH$的变化关系,A错误;若酸的初始浓度为$0.10 mol· L^{-1}$,$c_0(CH_2ClCOOH)=0.1 mol· L^{-1}$,$K_a=\frac{c(CH_2ClCOO^-)· c(^+H)}{c(CH_2ClCOOH)}$则$c(CH_2ClCOO^-) =c(^+H)=\sqrt{K_a(CHCl_2COOH)· c_0(CH_2ClCOOH)}=10^{-1.15}mol· L^{-1}$,a点$c(^+H)=0.1 mol/L$,说明加入酸性更强的酸,则$c(^+H)>c(CH_2ClCOOH)+c(OH^-)$;B错误;$K_a(CH_2ClCOOH)=\frac{c(CH_2ClCOO^-)· c(^+H)}{c(CH_2ClCOOH)}$,当$c(CH_2ClCOOH)=c(CH_2ClCOO^-)$时,$K_a(CH_2ClCOOH)=c(^+H)\approx10^{-2.8}$,同理,$K_a(CHCl_2COOH)=10^{-1.3}$,C错误;电离度$\alpha(CH_2ClCOOH)=\frac{\delta(CH_2ClCOO^-)}{\delta(CHCl_2COO^-)}=\frac{0.15}{0.85}$,D正确。
4. (2024·江西卷)废弃电池中锰可通过浸取回收。某温度下,${MnSO_{4}}$在不同浓度的$KOH$水溶液中,若$Mn$(Ⅱ)的分布系数$\delta$与$pH$的关系如图。下列说法正确的是(
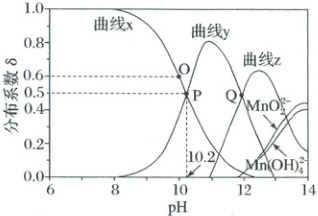
已知:$\delta({MnOH^{+}})=\frac{c({MnOH^{+}})}{c({Mn^{2+}}) + c({MnOH^{+}}) + c({HMnO^{-}_{2}}) + c[{Mn(OH)^{2-}_{4}}] + c({MnO^{2-}_{2}})}$;${Mn(OH)_{2}}$难溶于水,具有两性。
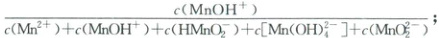
A.曲线$z$为$\delta({MnOH^{+}})$
B.$O$点,$c({H^{+}}) = \frac{2}{3}×10^{-10.2}\ mol· L^{-1}$
C.$P$点,$c({Mn^{2+}}) \lt c({K^{+}})$
D.$Q$点,$c({SO^{2-}_{4}}) = 2c({MnOH^{+}}) + 2c({MnO^{2-}_{2}})$
C
)已知:$\delta({MnOH^{+}})=\frac{c({MnOH^{+}})}{c({Mn^{2+}}) + c({MnOH^{+}}) + c({HMnO^{-}_{2}}) + c[{Mn(OH)^{2-}_{4}}] + c({MnO^{2-}_{2}})}$;${Mn(OH)_{2}}$难溶于水,具有两性。
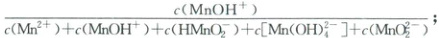

A.曲线$z$为$\delta({MnOH^{+}})$
B.$O$点,$c({H^{+}}) = \frac{2}{3}×10^{-10.2}\ mol· L^{-1}$
C.$P$点,$c({Mn^{2+}}) \lt c({K^{+}})$
D.$Q$点,$c({SO^{2-}_{4}}) = 2c({MnOH^{+}}) + 2c({MnO^{2-}_{2}})$
答案:
4.C 随着pH增大,$c(OH^-)$逐渐增大,$Mn^{2+}$逐步转化为$MnOH^+$、$HMnO_2$、$MnO_2^{2-}$、$Mn(OH)_4^{2-}$,则曲线x表示$\delta(Mn^{2+})$,曲线y表示$\delta(MnOH^+)$,曲线z表示$\delta(HMnO_2)$。由上述分析知,A项错误;P点$\delta(Mn^{2+})=\delta(MnOH^+)$,pH=10.2,即$c(Mn^{2+})=c(MnOH^+)$,$c(OH^-)=10^{-3.8}mol· L^{-1}$,则$Mn^{2+}+OH^-\rightleftharpoons MnOH^+$的$K=\frac{c(MnOH^+)}{c(Mn^{2+})· c(OH^-)}=10^{3.8}$,O点$\delta(Mn^{2+})=0.6$,$\delta(MnOH^+)=0.4$,代入平衡常数表达式得$K=\frac{c(MnOH^+)}{c(Mn^{2+})· c(OH^-)}=\frac{0.4}{0.6× c(OH^-)}=10^{3.8}$,解得$c(OH^-)=\frac{2}{3}×10^{-3.8}mol· L^{-1}$,则$c(^+H)=\frac{3}{2}×10^{-10.2}mol· L^{-1}$,B项错误;P点溶液显碱性,$\delta(Mn^{2+})=\delta(MnOH^+)$,结合$Mn^{2+}+OH^-\rightleftharpoons MnOH^+$,知$c(Mn^{2+})=c(MnOH^+)=c_消(OH^-)$,而$c(K^+)=c_消(OH^-)+c_剩(OH^-)$,所以$c(K^+)>c(Mn^{2+})$,C正确;Q点$c(MnOH^+)=c(HMnO_2^-)$,根据元素质量守恒$c(SO_4^{2-})=c(Mn^{2+})+c(MnOH^+)+c(HMnO_2)+c(MnO_2^{2-})+c[Mn(OH)_4^{2-}]$,知$c(SO_4^{2-})=c(Mn^{2+})+2c(MnOH^+)+c(MnO_2^{2-})+c[Mn(OH)_4^{2-}]$,D错误。
查看更多完整答案,请扫码查看


