2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·安徽省淮南市二模)一定温度下,AgCl和$Ag_{2}CrO_{4}$的沉淀溶解平衡曲线如图所示。$pAg=-lg[c(Ag^{+})/(mol· L^{-1})]$,$pX=-lg[c(X^{n-})/(mol· L^{-1})]$,$X^{n-}$代表$Cl^{-}$或$CrO_{4}^{2-}$。某实验小组以$K_{2}CrO_{4}$为指示剂,用$AgNO_{3}$标准溶液滴定含$Cl^{-}$的水样。下列说法正确的是(
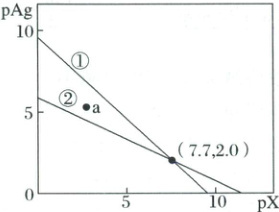
A.曲线①为$Ag_{2}CrO_{4}$沉淀溶解平衡曲线
B.a点条件下能生成$Ag_{2}CrO_{4}$沉淀,不能生成AgCl沉淀
C.$Ag_{2}CrO_{4}+2Cl^{-}\rightleftharpoons2AgCl+CrO_{4}^{2-}$的平衡常数$K=10^{-2}$
D.滴定终点时,若溶液中$c(K_{2}CrO_{4})=0.01mol· L^{-1}$,则$c(Cl^{-})=10^{-4.85}mol· L^{-1}$
D
)
A.曲线①为$Ag_{2}CrO_{4}$沉淀溶解平衡曲线
B.a点条件下能生成$Ag_{2}CrO_{4}$沉淀,不能生成AgCl沉淀
C.$Ag_{2}CrO_{4}+2Cl^{-}\rightleftharpoons2AgCl+CrO_{4}^{2-}$的平衡常数$K=10^{-2}$
D.滴定终点时,若溶液中$c(K_{2}CrO_{4})=0.01mol· L^{-1}$,则$c(Cl^{-})=10^{-4.85}mol· L^{-1}$
答案:
2.D根据图中直线斜率判断沉淀溶解平衡曲线①为$AgCl$沉淀溶解平衡曲线,A错误;a点条件下$Q(AgCl)>K(AgCl)$,能生成$AgCl$沉淀,$Q(Ag_{2}CrO_{4})<K(Ag_{2}CrO_{4})$,不能生成$Ag_{2}CrO_{4}$沉淀,B错误;由点$(7.7,2.0)$可知$pK_{sp}(Ag_{2}CrO_{4})=2p(Ag^{+})+p(CrO_{4}^{2-})=4.0+7.7=11.7$,$pK_{sp}(AgCl)=p(Ag^{+})+p(Cl^{-})=2.0+7.7=9.7$,$Ag_{2}CrO_{4}+2Cl^{-}\rightleftharpoons2AgCl+CrO_{4}^{2-}$的平衡常数$K=\frac{c(CrO_{4}^{2-})}{c^{2}(Cl^{-})}=\frac{K_{sp}(Ag_{2}CrO_{4})}{K^{2}_{sp}(AgCl)}=\frac{10^{-11.7}}{10^{-9.7×2}}=10^{7.7}$,C错误;滴定终点时,若溶液中$c(K_{2}CrO_{4})=0.01 mol·L^{-1}$,则$pAg=\frac{1}{2}[pK_{sp}(Ag_{2}CrO_{4})-p(CrO_{4}^{2-})]=\frac{1}{2}(11.7-2)=4.85$,$pCl=pK_{sp}(AgCl)-p(Ag^{+})=9.7-4.85=4.85$,$c(Cl^{-})=10^{-4.85} mol·L^{-1}$,D正确;答案选D。
3. (2025·辽宁二模)室温下,向$c(Al^{3+})$、$c(Zn^{2+})$均为$0.1mol· L^{-1}$的混合溶液中持续通入$H_{2}S$气体,始终保持$H_{2}S$饱和($H_{2}S$的物质的量浓度为$0.1mol· L^{-1}$),通过调节pH使$Al^{3+}$、$Zn^{2+}$分别沉淀,溶液中$-lgc$与pH的关系如图所示。其中,c表示$Al^{3+}$、$Zn^{2+}$、$OH^{-}$和$S^{2-}$的物质的量浓度的数值,$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$。下列说法错误的是(
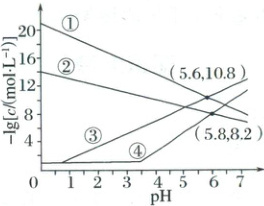
A.②代表$-lgc(OH^{-})$与pH的关系曲线
B.溶解度:$Al(OH)_{3}<Zn(OH)_{2}$
C.pH逐渐增大时,优先析出的沉淀是ZnS
D.$ZnS+2H^{+}\rightleftharpoons Zn^{2+}+H_{2}S$的平衡常数$K=10^{0.6}$
D
)
A.②代表$-lgc(OH^{-})$与pH的关系曲线
B.溶解度:$Al(OH)_{3}<Zn(OH)_{2}$
C.pH逐渐增大时,优先析出的沉淀是ZnS
D.$ZnS+2H^{+}\rightleftharpoons Zn^{2+}+H_{2}S$的平衡常数$K=10^{0.6}$
答案:
3.D依据纵坐标$-\lg c(OH^{-})$即为$pOH$,室温下$pOH+pH=14$,根据点$(5.8,8.2)$可推知②代表$OH^{-}$,$pH$越大,硫离子浓度越大,所以①代表$S^{2-}$;从$c(Al^{3+})$、$c(Zn^{2+})$均为$0.1 mol·L^{-1}$可知③④代表金属离子;根据②与④的交点坐标$(5.8,8.2)$可知此时$pH=5.8$,则$c(OH^{-})=10^{-8.2} mol/L$,同时根据$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$,则④代表$Al^{3+}$,③代表$Zn^{2+}$。
由分析知,②代表$-\lg c(OH^{-})$与$pH$的关系曲线,A不符合题意;根据分析曲线④代表$Al^{3+}$,曲线②与曲线④的交点坐标$(5.8,8.2)$,可知此时$pH=5.8$,则$c(OH^{-})=c(Al^{3+})=10^{-8.2} mol/L$,$K_{sp}[Al(OH)_{3}]=10^{-32.8}$,氢氧化铝的饱和溶液中铝离子浓度为$\sqrt[3]{\frac{1}{27}}×10^{-8.2} mol/L$,$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$,饱和氢氧化锌溶液中锌离子浓度为$\sqrt[3]{\frac{1.2×10^{-17}}{4}} mol/L=\sqrt[3]{3}×10^{-6} mol/L$,则溶解度:$Al(OH)_{3}<Zn(OH)_{2}$,B不符合题意;根据①和③交点$(5.6,10.8)$可知,$K_{sp}(ZnS)=c(Zn^{2+})· c(S^{2-})=10^{-10.8}×10^{-10.8}=10^{-21.6}$,硫化锌的饱和溶液中锌离子浓度为$10^{-10.8} mol/L$,$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$,饱和氢氧化锌溶液中锌离子浓度为$\sqrt[3]{\frac{1.2×10^{-17}}{4}} mol/L=\sqrt[3]{3}×10^{-6} mol/L$,则$ZnS$更容易生成,则随$pH$逐渐增大时,溶液中优先析出的沉淀为$ZnS$,C不符合题意;可利用坐标$(5.6,10.8)$来计算,则$K_{a1}· K_{a2}=\frac{c(H^{+})· c(HS^{-})· c(H^{+})· c(S^{2-})}{c(H_{2}S)· c(HS^{-})}=\frac{c^{2}(H^{+})· c(S^{2-})}{c(H_{2}S)· c(HS^{-})}=\frac{10^{-5.6}×10^{-5.6}×10^{-10.8}}{0.1}=10^{-21}$,$ZnS+2H^{+}\rightleftharpoonsZn^{2+}+H_{2}S$的平衡常数$K=\frac{c(Zn^{2+})· c(H_{2}S)}{c^{2}(H^{+})}=\frac{c(Zn^{2+})· c(S^{2-})· c(H_{2}S)}{c^{2}(H^{+})· c(S^{2-})}=\frac{K_{sp}(ZnS)}{K_{a1}· K_{a2}}=\frac{10^{-21.6}}{10^{-21}}=10^{-0.6}$,D符合题意;故选D。
由分析知,②代表$-\lg c(OH^{-})$与$pH$的关系曲线,A不符合题意;根据分析曲线④代表$Al^{3+}$,曲线②与曲线④的交点坐标$(5.8,8.2)$,可知此时$pH=5.8$,则$c(OH^{-})=c(Al^{3+})=10^{-8.2} mol/L$,$K_{sp}[Al(OH)_{3}]=10^{-32.8}$,氢氧化铝的饱和溶液中铝离子浓度为$\sqrt[3]{\frac{1}{27}}×10^{-8.2} mol/L$,$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$,饱和氢氧化锌溶液中锌离子浓度为$\sqrt[3]{\frac{1.2×10^{-17}}{4}} mol/L=\sqrt[3]{3}×10^{-6} mol/L$,则溶解度:$Al(OH)_{3}<Zn(OH)_{2}$,B不符合题意;根据①和③交点$(5.6,10.8)$可知,$K_{sp}(ZnS)=c(Zn^{2+})· c(S^{2-})=10^{-10.8}×10^{-10.8}=10^{-21.6}$,硫化锌的饱和溶液中锌离子浓度为$10^{-10.8} mol/L$,$K_{sp}[Zn(OH)_{2}]=1.2×10^{-17}$,饱和氢氧化锌溶液中锌离子浓度为$\sqrt[3]{\frac{1.2×10^{-17}}{4}} mol/L=\sqrt[3]{3}×10^{-6} mol/L$,则$ZnS$更容易生成,则随$pH$逐渐增大时,溶液中优先析出的沉淀为$ZnS$,C不符合题意;可利用坐标$(5.6,10.8)$来计算,则$K_{a1}· K_{a2}=\frac{c(H^{+})· c(HS^{-})· c(H^{+})· c(S^{2-})}{c(H_{2}S)· c(HS^{-})}=\frac{c^{2}(H^{+})· c(S^{2-})}{c(H_{2}S)· c(HS^{-})}=\frac{10^{-5.6}×10^{-5.6}×10^{-10.8}}{0.1}=10^{-21}$,$ZnS+2H^{+}\rightleftharpoonsZn^{2+}+H_{2}S$的平衡常数$K=\frac{c(Zn^{2+})· c(H_{2}S)}{c^{2}(H^{+})}=\frac{c(Zn^{2+})· c(S^{2-})· c(H_{2}S)}{c^{2}(H^{+})· c(S^{2-})}=\frac{K_{sp}(ZnS)}{K_{a1}· K_{a2}}=\frac{10^{-21.6}}{10^{-21}}=10^{-0.6}$,D符合题意;故选D。
1. (2025·河北卷)已知 $ Cu^{2+} $ 和 $ L^{3-} $ 结合形成两种配离子 $ [CuL]^- $ 和 $ [CuL_2]^{4-} $。常温下,$ 0.100 \, mol · L^{-1} $ 的 $ H_3L $ 和 $ 0.002 \, mol · L^{-1} $ 的 $ CuSO_4 $ 混合溶液中,$ HL^{2-} $ 和 $ L^{3-} $ 的浓度对数 $ lg \, c $(实线)、含铜微粒的分布系数 $ \delta $(虚线)[例如 $ \delta_{Cu^{2+}} = \frac{c(Cu^{2+})}{c(Cu^{2+}) + c([CuL]^-) + c([CuL_2]^{4-})} $]与溶液 $ pH $ 的关系如图所示:
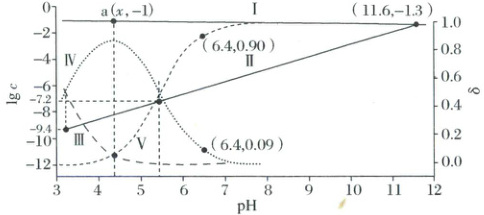
下列说法错误的是(
A.$ Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^- $,$ K = 10^{9.4} $
B.$ HL^{2-} \rightleftharpoons H^+ + L^{3-} $,$ K = 10^{-11.6} $
C.图中 $ a $ 点对应的 $ pH = 4.2 $
D.当 $ pH = 6.4 $ 时,体系中 $ c(HL^{2-}) > c([CuL_2]^{4-}) > c([CuL]^-) > c(L^{3-}) $

下列说法错误的是(
C
)A.$ Cu^{2+} + L^{3-} \rightleftharpoons [CuL]^- $,$ K = 10^{9.4} $
B.$ HL^{2-} \rightleftharpoons H^+ + L^{3-} $,$ K = 10^{-11.6} $
C.图中 $ a $ 点对应的 $ pH = 4.2 $
D.当 $ pH = 6.4 $ 时,体系中 $ c(HL^{2-}) > c([CuL_2]^{4-}) > c([CuL]^-) > c(L^{3-}) $
答案:
1.C随pH不断增大,则$c(L^{3-})$不断增大,则Ⅱ代表$\lgC(L^{3-})$,Ⅰ代表$\lg c(HL^{2-})$(实线);$c(L^{3-})$不断增大,$c(Cu^{2+})$不断减小,$c([CuL_2]^{4-})$不断增大,$c([CuL]^-)$先增大后减小,则Ⅲ代表$\deltaCu^{2+}$,Ⅳ代表$\delta[CuL_2]^{4-}$,Ⅴ代表$\delta[CuL]^-$;由图可知,曲线Ⅲ与曲线Ⅳ交点处$\delta(Cu^{2+})=\delta([CuL]^-)$,即$c(Cu^{2+})=c([CuL]^-)$,此时$\lg c(L^{3-})=-9.4$,$c(L^{3-})=10^{-9.4}mol·L^{-1}$,故$K=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}=\frac{1}{10^{-9.4}}=10^{9.4}$,A正确;曲线Ⅰ和曲线Ⅱ的交点处$c(L^{3-})=c(HL^{2-})$,此时$pH=11.6$,即$c(H^+)=10^{-11.6}mol·L^{-1}$,故$K=\frac{c(L^{3-})· c(H^+)}{c(HL^{2-})}=10^{-11.6}$,B正确;由图可知,a点处$c(HL^{2-})=0.100mol·L^{-1}$,且存在$c(Cu^{2+})=c([CuL_2]^{4-})$,$[CuL]^- + L^{3-}\rightleftharpoons[CuL_2]^{4-}-K'$,代入$K· K'=\frac{c([CuL]^-)}{c(Cu^{2+})· c(L^{3-})}×\frac{c([CuL_2]^{4-})}{c([CuL]^-)· c(L^{3-})}=\frac{1}{c^{2}(L^{3-})}=10^{9.4}×10^{7.2}=10^{16.6}$,解得$c(L^{3-})=10^{-8.3}mol·L^{-1}$,代入$K=\frac{c(L^{3-})· c(H^+)}{c(HL^{2-})}=10^{-11.6}$得,$c(H^+)=10^{-4.3}mol·L^{-1}$,即$pH=4.3$,C错误;$pH=6.4$时,$c(HL^{2-})$约为$0.1mol·L^{-1}$,结合$HL^{2-}\rightleftharpoonsH^++L^{3-}\quad K=10^{-11.6}$,故$c(L^{3-})\approx10^{-6.2}mol·L^{-1}$,$c([CuL_2]^{4-})=0.90×0.002mol·L^{-1}=1.8×10^{-3}mol·L^{-1}$,$c([CuL]^-)=0.09×0.002mol·L^{-1}=1.8×10^{-6}mol·L^{-1}$,故$c(HL^{2-})>c([CuL_2]^{4-})>c([CuL]^-)>c(L^{3-})$,D正确。
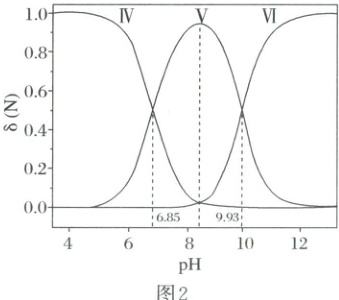
2. (2025·河南卷)乙二胺($ H_2NCH_2CH_2NH_2 $,简写为 $ Y $)可结合 $ H^+ $ 转化为 $ [H_2NCH_2CH_2NH_3]^+ $(简写为 $ HY^+ $)$ [H_3NCH_2CH_2NH_3]^{2+} $(简写为 $ H_2Y^{2+} $)。$ Ag^+ $ 与 $ Y $ 可形成 $ [AgY]^+ $ 和 $ [AgY_2]^+ $ 两种配离子。室温下向 $ AgNO_3 $ 溶液中加入 $ Y $,通过调节混合溶液的 $ pH $ 改变 $ Y $ 的浓度,从而调控不同配离子的浓度(忽略体积变化)。混合溶液中 $ Ag^+ $ 和 $ Y $ 的初始浓度分别为 $ 1.00 × 10^{-3} \, mol · L^{-1} $ 和 $ 1.15 × 10^{-2} \, mol · L^{-1} $。$ -lg[c(M) / (mol · L^{-1})] $ 与 $ -lg[c(Y) / (mol · L^{-1})] $ 的变化关系如图 1 所示(其中 $ M $ 代表 $ Ag^+ $、$ [AgY]^+ $ 或 $ [AgY_2]^+ $),分布系数 $ \delta(N) $ 与 $ pH $ 的变化关系如图 2 所示(其中 $ N $ 代表 $ Y $、$ HY^+ $ 或 $ H_2Y^{2+} $),比如 $ \delta(H_2Y^{2+}) = \frac{c(H_2Y^{2+})}{c(Y) + c(HY^+) + c(H_2Y^{2+})} $。
下列说法错误的是(
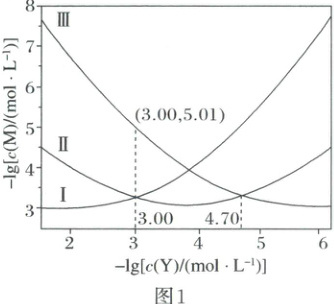
A.曲线Ⅰ对应的离子是 $ [AgY_2]^+ $
B.$ \delta(HY^+) $ 最大时对应的 $ pH = 8.39 $
C.反应 $ Ag^+ + Y \rightleftharpoons [AgY]^+ $ 的平衡常数 $ K_1 = 10^{4.70} $
D.$ -lg[c(Y) / (mol · L^{-1})] = 3.00 $ 时,$ c(HY^+) > c(H_2Y^{2+}) > c(Y) $
下列说法错误的是(
D
)
A.曲线Ⅰ对应的离子是 $ [AgY_2]^+ $
B.$ \delta(HY^+) $ 最大时对应的 $ pH = 8.39 $
C.反应 $ Ag^+ + Y \rightleftharpoons [AgY]^+ $ 的平衡常数 $ K_1 = 10^{4.70} $
D.$ -lg[c(Y) / (mol · L^{-1})] = 3.00 $ 时,$ c(HY^+) > c(H_2Y^{2+}) > c(Y) $

答案:
2.D含Ag物种存在平衡:$[AgY_2]^+\rightleftharpoonsY+[AgY]^+(K_{D1})$、$[AgY]^+\rightleftharpoonsY+Ag^+(K_{D2})$,随着$-\lg[c(Y)/(mol·L^{-1})]$增大,即$c(Y)$减小,$[AgY_2]^+$减少、$[AgY]^+$先增加后减少、$Ag^+$增加,则曲线Ⅰ、Ⅱ、Ⅲ分别对应$[AgY_2]^+$、$[AgY]^+$、$Ag^+$。将$H_2Y^{2+}$视为二元弱酸,则其存在如下平衡:$H_2Y^{2+}\rightleftharpoonsH^++HY^+(K_{a1})$、$HY^+\rightleftharpoonsH^++Y(K_{a2})$,随着pH增大,$H_2Y^{2+}$减少、$H^+$先增加后减少、Y增加,故三者分别对应曲线Ⅳ、Ⅴ、Ⅵ。Ⅳ、Ⅴ交点处$pH=6.85$、$c(H_2Y^{2+})=c(HY^+)$,故$K_{a1}=\frac{c(H^+)· c(HY^+)}{c(H_2Y^{2+})}=c(H^+)=10^{-6.85}$,同理,可得$K_{a2}=10^{-9.93}$。由上述分析知,A正确;$K_{a1}× K_{a2}=\frac{c(HY^+)· c(H^+)}{c(H_2Y^{2+})}×\frac{c(Y)· c(H^+)}{c(HY^+)}=10^{-6.85}×10^{-9.93}=10^{-16.78}$,$\delta(HY^+)$最大时,溶液中$c(H_2Y^{2+})=c(Y)$,则$c^{2}(H^+)=10^{-16.78}mol^{2}·L^{-2}$,解得$c(H^+)=10^{-8.39}mol·L^{-1}$,$pH=8.39$,B正确;$Ag^++Y\rightleftharpoons[AgY]^+$的平衡常数$K_1=\frac{c([AgY]^+)}{c(Ag^+)· c(Y)}$,曲线Ⅱ、Ⅲ的交点处$c(Ag^+)=c([AgY]^+)$,$c(Y)=10^{-4.70}mol·L^{-1}$,故$K_1=10^{4.70}$,C正确;由Ag守恒可知:$1.00×10^{-3}mol·L^{-1}=c(Ag^+)+c([AgY]^+)+c([AgY_2]^+)$,$-\lg[c(Y)/(mol·L^{-1})]=3.00$时,$c(Ag^+)=10^{-5.01}mol·L^{-1}\approx10^{-5}mol·L^{-1}$、$c([AgY]^+)=c([AgY_2]^+)=4.95×10^{-4}mol·L^{-1}\approx5.0×10^{-4}mol·L^{-1}$,由Y守恒可知:$1.15×10^{-2}mol·L^{-1}=2c([AgY_2]^+)+c([AgY]^+)+c(Y)+c(HY^+)+c(H_2Y^{2+})$,将$c([AgY_2]^+)$、$c([AgY]^+)$代入计算可得$c(Y)+c(HY^+)+c(H_2Y^{2+})\approx1.15×10^{-2}mol·L^{-1}-3×5.0×10^{-4}mol·L^{-1}=1.00×10^{-2}mol·L^{-1}$,则$\delta(Y)=\frac{c(Y)}{c(H_2Y^{2+})+c(HY^+)+c(Y)}=\frac{1.0×10^{-3}mol·L^{-1}}{1.0×10^{-2}mol·L^{-1}}=0.1$,由图2知,$\delta(Y)=0.1$时$c(H^+)>c(Y)>c(H_2Y^{2+})$,故D错误。
查看更多完整答案,请扫码查看


