2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·甘肃卷)处理某酸浸液(主要含${Li^{+}}$、${Fe^{2+}}$、${Cu^{2+}}$、${Al^{3+}}$)的部分流程如下:
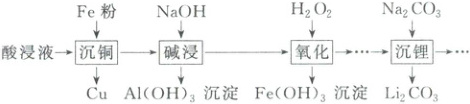
下列说法正确的是(
A.“沉铜”过程中发生反应的离子方程式:${2Fe + 3Cu^{2+}\xlongequal{}3Cu + 2Fe^{3+}}$
B.“碱浸”过程中${NaOH}$固体加入量越多,${Al(OH)_{3}}$沉淀越完全
C.“氧化”过程中铁元素化合价降低
D.“沉锂”过程利用了${Li_{2}CO_{3}}$的溶解度比${Na_{2}CO_{3}}$小的性质

下列说法正确的是(
D
)A.“沉铜”过程中发生反应的离子方程式:${2Fe + 3Cu^{2+}\xlongequal{}3Cu + 2Fe^{3+}}$
B.“碱浸”过程中${NaOH}$固体加入量越多,${Al(OH)_{3}}$沉淀越完全
C.“氧化”过程中铁元素化合价降低
D.“沉锂”过程利用了${Li_{2}CO_{3}}$的溶解度比${Na_{2}CO_{3}}$小的性质
答案:
1.D “沉锂”过程中加入$Na_{2}CO_{3}$后有$Li_{2}CO_{3}$析出,利用了$Li_{2}CO_{3}$的溶解度比$Na_{2}CO_{3}$小的性质,D正确;“沉铜”过程中,$Fe$与$Cu^{2+}$发生置换反应生成$Fe^{2+}$和$Cu$,正确的离子方程式为$Fe + Cu^{2+}=Fe^{2+} + Cu$,A错误;“碱浸”过程中若$NaOH$过量,会使$Al(OH)_{3}$转化为可溶于水的$[Al(OH)_{4}]^{-}$,B错误;由上述分析知,“氧化”前$Fe$元素的化合价为$ + 2$,“氧化”后得到$Fe(OH)_{3}$沉淀,$Fe$的化合价升高,C错误。
2. (2025·黑吉辽蒙卷)某工厂利用生物质(稻草)从高锰钴矿(含${MnO_{2}}$、${Co_{3}O_{4}}$和少量${Fe_{2}O_{3}}$)中提取金属元素,流程如图。已知“沉钴”温度下$K_{sp}({CoS}) = 10^{-20.4}$,下列说法错误的是(
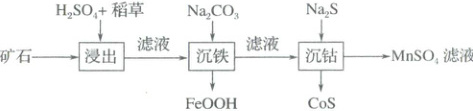
A.硫酸用作催化剂和浸取剂
B.使用生物质的优点是其来源广泛且可再生
C.“浸出”时,$3$种金属元素均被还原
D.“沉钴”后上层清液中$c({Co^{2+}})· c({S^{2-}}) = 10^{-20.4}$
C
)
A.硫酸用作催化剂和浸取剂
B.使用生物质的优点是其来源广泛且可再生
C.“浸出”时,$3$种金属元素均被还原
D.“沉钴”后上层清液中$c({Co^{2+}})· c({S^{2-}}) = 10^{-20.4}$
答案:
2.C “浸出”过程中硫酸可作催化剂催化稻草中的纤维素水解生成葡萄糖,还可作浸取剂与金属氧化物反应得到含金属离子的溶液,A正确;该流程中所用生物质为稻草,而稻草来源广泛且可再生,故B正确;结合“浸出”后的操作及产物可知,“浸出”时$MnO_{2}$被葡萄糖还原为$Mn^{2 + }$,$Co_{3}O_{4}$被还原为$Co^{2 + }$,$Fe_{2}O_{3}$转化为$Fe^{3 + }$,$Fe$的化合价不变,故$Fe$未被还原,C错误;“沉钴”后的上层清液为$CoS$的饱和溶液,存在$c(Co^{2 + }) · c(S^{2 - }) = K_{sp}(CoS) = 10^{-20.4}$,D正确。
3. (2025·山东卷)钢渣中富含${CaO}$、${SiO_{2}}$、${FeO}$、${Fe_{2}O_{3}}$等氧化物,实验室利用酸碱协同法分离钢渣中的${Ca}$、${Si}$、${Fe}$元素,流程如下。已知:${Fe_{2}(C_{2}O_{4})_{3}}$能溶于水;$K_{sp}({CaC_{2}O_{4}}) = 2.3× 10^{-9}$,$K_{sp}({FeC_{2}O_{4}}) = 3.2× 10^{-7}$。下列说法错误的是(
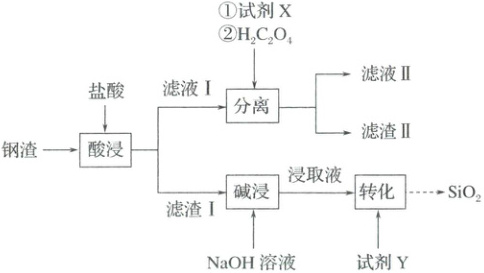
A.试剂$X$可选用${Fe}$粉
B.试剂$Y$可选用盐酸
C.“分离”后${Fe}$元素主要存在于滤液Ⅱ中
D.“酸浸”后滤液Ⅰ的${pH}$过小会导致滤渣Ⅱ质量减少
A
)
A.试剂$X$可选用${Fe}$粉
B.试剂$Y$可选用盐酸
C.“分离”后${Fe}$元素主要存在于滤液Ⅱ中
D.“酸浸”后滤液Ⅰ的${pH}$过小会导致滤渣Ⅱ质量减少
答案:
3.A 钢渣用盐酸酸浸后,$CaO$、$FeO$、$Fe_{2}O_{3}$分别转化成$Ca^{2 + }$、$Fe^{2 + }$、$Fe^{3 + }$进入滤液Ⅰ中,则滤渣Ⅰ为$SiO_{2}$,根据已知信息,$CaC_{2}O_{4}$的$K_{sp}$与$FeC_{2}O_{4}$的接近,而$Fe_{2}(C_{2}O_{4})_{3}$能溶于水,则要想有效分离$Ca$、$Fe$元素,滤渣Ⅱ只能是$CaC_{2}O_{4}$,为了防止生成$FeC_{2}O_{4}$,需要将滤液Ⅰ中的$Fe^{2 + }$完全转化成$Fe^{3 + }$以保证$Fe$元素留在滤液Ⅱ中,因此试剂$X$需氧化$Fe^{2 + }$,滤渣Ⅰ用$NaOH$溶液碱浸得到$Na_{2}SiO_{3}$溶液,向其中加入试剂$Y$经一系列操作得到$SiO_{2}$。结合上述分析可知,试剂$X$不能用$Fe$粉,A错误;向$Na_{2}SiO_{3}$溶液中加酸可得到$H_{2}SiO_{3}$,$H_{2}SiO_{3}$受热分解可得到$SiO_{2}$,因此试剂$Y$可以为盐酸,B正确;“分离”后,$Fe$元素在滤液Ⅱ中,C正确;$CaC_{2}O_{4}$存在沉淀溶解平衡:$CaC_{2}O_{4}(s)=Ca^{2 + }(aq) + C_{2}O_{4}^{2 - }(aq)$,若酸浸后滤液Ⅰ的$pH$过小,则$C_{2}O_{4}^{2 - }$与$H^{ + }$结合导致$C_{2}O_{4}^{2 - }$浓度降低,平衡正向移动,导致$CaC_{2}O_{4}$的质量减少,D正确。
4. (2024·黑吉辽)某工厂利用铜屑脱除锌浸出液中的${Cl^{-}}$并制备${Zn}$,流程如下。“脱氯”步骤仅${Cu}$元素化合价发生改变。下列说法正确的是(
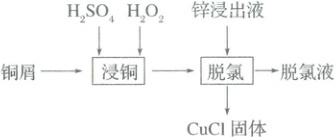
锌浸出液中相关成分(其他成分无干扰)

A.“浸铜”时应加入足量${H_{2}O_{2}}$,确保铜屑溶解完全
B.“浸铜”反应:${2Cu + 4H^{+} + H_{2}O_{2}\xlongequal{}2Cu^{2+} + H_{2}\uparrow + 2H_{2}O}$
C.“脱氯”反应:${Cu + Cu^{2+} + 2Cl^{-}\xlongequal{}2CuCl}$
D.脱氯液净化后电解,可在阳极得到${Zn}$
C
)
锌浸出液中相关成分(其他成分无干扰)

A.“浸铜”时应加入足量${H_{2}O_{2}}$,确保铜屑溶解完全
B.“浸铜”反应:${2Cu + 4H^{+} + H_{2}O_{2}\xlongequal{}2Cu^{2+} + H_{2}\uparrow + 2H_{2}O}$
C.“脱氯”反应:${Cu + Cu^{2+} + 2Cl^{-}\xlongequal{}2CuCl}$
D.脱氯液净化后电解,可在阳极得到${Zn}$
答案:
4.C 结合“脱氯”步骤仅$Cu$元素化合价发生改变并产生$CuCl$固体,可推断“脱氯”时$Cu$和$Cu^{2 + }$发生归中反应并结合$Cl^{-}$生成$CuCl$沉淀,离子方程式为$Cu + Cu^{2 + } + 2Cl^{-}=2CuCl$,则“浸铜”时铜屑不能完全溶解,A错误,C正确;“浸铜”时$Cu$与$H_{2}O_{2}$在酸性条件下反应生成$Cu^{2 + }$和$H_{2}O$,离子方程式为$Cu + 2H^{ + } + H_{2}O_{2}=Cu^{2 + } + 2H_{2}O$,B错误;脱氯液中含大量的$Zn^{2 + }$,净化后电解,$Zn^{2 + }$在阴极上得电子生成单质$Zn$,D错误。
5. (2024·湖南卷)中和法生产${Na_{2}HPO_{4}· 12H_{2}O}$的工艺流程如下:
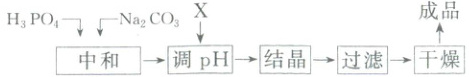
已知:①${H_{3}PO_{4}}$的电离常数:$K_{a1} = 6.9× 10^{-3}$,$K_{a2} = 6.2× 10^{-8}$,$K_{a3} = 4.8× 10^{-13}$。
②${Na_{2}HPO_{4}· 12H_{2}O}$易风化。
下列说法错误的是(
A.“中和”工序若在铁质容器中进行,应先加入${Na_{2}CO_{3}}$溶液
B.“调${pH}$”工序中$X$为${NaOH}$或${H_{3}PO_{4}}$
C.“结晶”工序中溶液显酸性
D.“干燥”工序需在低温下进行

已知:①${H_{3}PO_{4}}$的电离常数:$K_{a1} = 6.9× 10^{-3}$,$K_{a2} = 6.2× 10^{-8}$,$K_{a3} = 4.8× 10^{-13}$。
②${Na_{2}HPO_{4}· 12H_{2}O}$易风化。
下列说法错误的是(
C
)A.“中和”工序若在铁质容器中进行,应先加入${Na_{2}CO_{3}}$溶液
B.“调${pH}$”工序中$X$为${NaOH}$或${H_{3}PO_{4}}$
C.“结晶”工序中溶液显酸性
D.“干燥”工序需在低温下进行
答案:
5.C $H_{3}PO_{4}$和$Na_{2}CO_{3}$先发生反应,通过加入$X$调节$pH$,使产物完全转化为$Na_{2}HPO_{4}$,通过结晶、过滤、干燥,最终得到$Na_{2}HPO_{4} · 12H_{2}O$成品。铁是较活泼金属,可与$H_{3}PO_{4}$反应生成氢气,故“中和”工序若在铁质容器中进行,应先加入$Na_{2}CO_{3}$溶液,A项正确。若“中和”工序加入$Na_{2}CO_{3}$过量,则需要加入酸性物质来调节$pH$,为了不引入新杂质,可加入$H_{3}PO_{4}$;若“中和”工序加入$H_{3}PO_{4}$过量,则需要加入碱性物质来调节$pH$,为了不引入新杂质,可加入$NaOH$,所以“调$pH$”工序中$X$为$NaOH$或$H_{3}PO_{4}$,B项正确。“结晶”工序中的溶液为饱和$Na_{2}HPO_{4}$溶液,由已知信息可知$H_{3}PO_{4}$的$K_{a2} = 6.2 × 10^{-8}$,$K_{a3} = 4.8 × 10^{-13}$,则$HPO_{4}^{2 - }$的水解常数$K_{h} = \frac{K_{w}}{K_{a2}} = \frac{1.0 × 10^{-14}}{6.2 × 10^{-8}} \approx 1.6 × 10^{-7}$,由于$K_{h} > K_{a3}$,则$HPO_{4}^{2 - }$的水解程度大于其电离程度,溶液显碱性,C项错误。由于$Na_{2}HPO_{4} · 12H_{2}O$易风化失去结晶水,故“干燥”工序需要在低温下进行,D项正确。
查看更多完整答案,请扫码查看


