2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
3. (2025·山东卷)采用两段焙烧—水浸法从铁锰氧化矿(主要含$Fe_2O_3$、$MnO_2$及$Co$、$Cu$、$Ca$、$Si$等元素的氧化物)分离提取$Cu$、$Co$、$Mn$等元素,工艺流程如下:
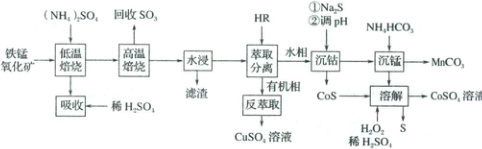
已知:该工艺条件下,$(NH_4)_2SO_4$低温分解生成$NH_4HSO_4$,高温则完全分解为气体;$Fe_2(SO_4)_3$在$650℃$完全分解,其他金属硫酸盐分解温度均高于$700℃$。
回答下列问题:
(1)“低温焙烧”时金属氧化物均转化为硫酸盐。$MnO_2$与$NH_4HSO_4$反应转化为$MnSO_4$时有$N_2$生成,该反应的化学方程式为________。“高温焙烧”温度为$650℃$,“水浸”所得滤渣主要成分除$SiO_2$外还含有________(填化学式)。
(2)在$(NH_4)_2SO_4$投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率(填“增大”“减小”或“不变”)。
(3)HR萃取$Cu^{2+}$的反应为:$2HR(有机相)+Cu^{2+}(水相)\rightleftharpoons CuR_2(有机相)+2H^+(水相)$。“反萃取”时加入的试剂为(填化学式)。
(4)“沉钴”中,$pH=4$时$Co^{2+}$恰好沉淀完全$[c(Co^{2+})=1×10^{-5}mol·L^{-1}]$,则此时溶液中$c(H_2S)=$________$mol·L^{-1}$。已知:$K_{a1}(H_2S)=1×10^{-7}$,$K_{a2}(H_2S)=1×10^{-13}$,$K_{sp}(CoS)=4×10^{-21}$。$CoS$“溶解”时发生反应的离子方程式为________。
(5)“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入(填操作单元名)循环利用。

已知:该工艺条件下,$(NH_4)_2SO_4$低温分解生成$NH_4HSO_4$,高温则完全分解为气体;$Fe_2(SO_4)_3$在$650℃$完全分解,其他金属硫酸盐分解温度均高于$700℃$。
回答下列问题:
(1)“低温焙烧”时金属氧化物均转化为硫酸盐。$MnO_2$与$NH_4HSO_4$反应转化为$MnSO_4$时有$N_2$生成,该反应的化学方程式为________。“高温焙烧”温度为$650℃$,“水浸”所得滤渣主要成分除$SiO_2$外还含有________(填化学式)。
(2)在$(NH_4)_2SO_4$投料量不变的情况下,与两段焙烧工艺相比,直接“高温焙烧”,“水浸”时金属元素的浸出率(填“增大”“减小”或“不变”)。
(3)HR萃取$Cu^{2+}$的反应为:$2HR(有机相)+Cu^{2+}(水相)\rightleftharpoons CuR_2(有机相)+2H^+(水相)$。“反萃取”时加入的试剂为(填化学式)。
(4)“沉钴”中,$pH=4$时$Co^{2+}$恰好沉淀完全$[c(Co^{2+})=1×10^{-5}mol·L^{-1}]$,则此时溶液中$c(H_2S)=$________$mol·L^{-1}$。已知:$K_{a1}(H_2S)=1×10^{-7}$,$K_{a2}(H_2S)=1×10^{-13}$,$K_{sp}(CoS)=4×10^{-21}$。$CoS$“溶解”时发生反应的离子方程式为________。
(5)“沉锰”所得滤液并入“吸收”液中,经处理后所得产品导入(填操作单元名)循环利用。
答案:
(1)$3MnO_{2} + 3NH_{4}HSO_{4}\begin{matrix} \underline{\underline{低温焙烧}} \\ \end{matrix}3MnSO_{4} + N_{2}\uparrow + 6H_{2}O\uparrow + NH_{3}\uparrow$ $Fe_{2}O_{3}、CaSO_{4}$
(2)减小
(3)$H_{2}SO_{4}$
(4)$4×10^{-4}$ $CoS + H_{2}O_{2} + 2H^{+}=S + Co^{2 + } + 2H_{2}O$
(5)低温焙烧
(1)$3MnO_{2} + 3NH_{4}HSO_{4}\begin{matrix} \underline{\underline{低温焙烧}} \\ \end{matrix}3MnSO_{4} + N_{2}\uparrow + 6H_{2}O\uparrow + NH_{3}\uparrow$ $Fe_{2}O_{3}、CaSO_{4}$
(2)减小
(3)$H_{2}SO_{4}$
(4)$4×10^{-4}$ $CoS + H_{2}O_{2} + 2H^{+}=S + Co^{2 + } + 2H_{2}O$
(5)低温焙烧
查看更多完整答案,请扫码查看


