2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第76页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. (2025·江苏常州二模)室温下,根据下列实验过程及现象,能得出相应实验结论的是(
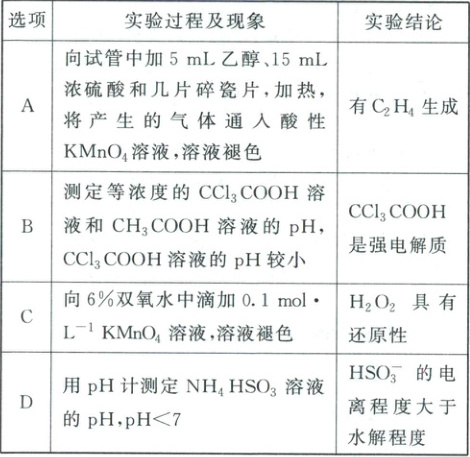
C
)
答案:
2.C 挥发的乙醇可使酸性高锰酸钾溶液褪色,则紫色褪去,不能说明有$C_2H_4$生成,故A不符合题意;测定等浓度的$CCl_3COOH$溶液和$CH_3COOH$溶液的$pH$,$CCl_3COOH$溶液的$pH$较小,只能证明酸性$CCl_3COOH$大于$CH_3COOH$,不能说明$CCl_3COOH$是强电解质,B不符合题意;$KMnO_4$具有氧化性,向$6\%$双氧水中滴加$0.1\ mol·L^{-1}\ KMnO_4$溶液,溶液褪色,说明$H_2O_2$具有还原性,C符合题意;$NH_4^+$水解显酸性,$NH_4HSO_3$溶液的$pH<7$,不能证明$HSO_3^-$的电离程度大于水解程度,D不符合题意;答案选C。
3. (2025·山东名校大联考4月联合检测)某化学学习小组为探究$Fe^{3+}$在溶液中的颜色变化,进行以下实验。
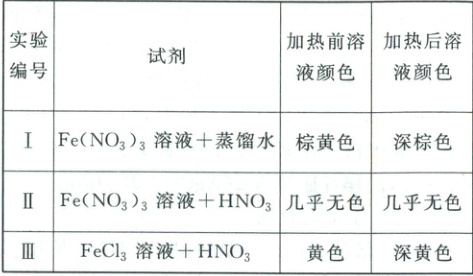
已知:水溶液中,$[Fe(H_{2}O)_{6}]^{3+}$几乎无色,$[Fe(H_{2}O)_{6}]^{3+}$水解生成$[Fe(H_{2}O)_{6 - n}(OH)_{n}]^{3 - n}$(棕黄色);$[FeCl_{4}(H_{2}O)_{2}]^{-}$为黄色。
下列说法错误的是(
A.实验Ⅰ加热前后颜色变化的原因为$[Fe(H_{2}O)_{6}]^{3+}+nH_{2}O\rightleftharpoons[Fe(H_{2}O)_{6 - n}(OH)_{n}]^{3 - n}+nH_{3}O^{+}(n = 1\sim6)$,加热后平衡正向移动,颜色变深
B.实验Ⅱ中溶液颜色无明显变化的原因为$H^{+}$对平衡的影响大于温度对平衡的影响
C.常温下,向实验Ⅱ的溶液中加入一定浓度的$NaCl$溶液后,溶液可变为黄色
D.三组实验说明,可用$HCl$调节$pH$探究$Fe^{3+}$显色的原因

已知:水溶液中,$[Fe(H_{2}O)_{6}]^{3+}$几乎无色,$[Fe(H_{2}O)_{6}]^{3+}$水解生成$[Fe(H_{2}O)_{6 - n}(OH)_{n}]^{3 - n}$(棕黄色);$[FeCl_{4}(H_{2}O)_{2}]^{-}$为黄色。
下列说法错误的是(
D
)A.实验Ⅰ加热前后颜色变化的原因为$[Fe(H_{2}O)_{6}]^{3+}+nH_{2}O\rightleftharpoons[Fe(H_{2}O)_{6 - n}(OH)_{n}]^{3 - n}+nH_{3}O^{+}(n = 1\sim6)$,加热后平衡正向移动,颜色变深
B.实验Ⅱ中溶液颜色无明显变化的原因为$H^{+}$对平衡的影响大于温度对平衡的影响
C.常温下,向实验Ⅱ的溶液中加入一定浓度的$NaCl$溶液后,溶液可变为黄色
D.三组实验说明,可用$HCl$调节$pH$探究$Fe^{3+}$显色的原因
答案:
3.D 根据已知信息可知,$Fe(NO_3)_3$溶液中存在水解平衡$[Fe(H_2O)_6]^{3+}+nH_2O\rightleftharpoons[Fe(H_2O)_{6-n}(OH)_n]^{3-n}+nH^+$($n=1\sim6$),水解反应是吸热反应,升高温度,水解平衡正向移动,$[Fe(H_2O)_{6-n}(OH)_n]^{3-n}$的浓度增大,颜色变深,A正确;实验Ⅱ中,升高温度,$[Fe(H_2O)_6]^{3+}$的水解平衡正向移动,$[Fe(H_2O)_{6-n}(OH)_n]^{3-n}$浓度增大。加入$HNO_3$,溶液中$c(H^+)$增大,抑制了$[Fe(H_2O)_6]^{3+}$的水解。由溶液颜色无明显变化,可判断$H^+$对平衡的影响大于温度对平衡的影响,B正确;常温下,向实验Ⅱ的溶液中加入一定浓度的$NaCl$溶液后,发生反应$Fe^{3+}+4Cl^-+2H_2O\rightleftharpoons[FeCl_4(H_2O)_2]^-$,所以溶液变为黄色,C正确;向实验Ⅱ的溶液中加入一定浓度的$NaCl$溶液后,发生反应$Fe^{3+}+4Cl^-+2H_2O\rightleftharpoons[FeCl_4(H_2O)_2]^-$,溶液变为黄色,可知$Cl^-$浓度对$Fe^{3+}$在溶液中的颜色有影响,而$HCl$中含有$Cl^-$,因此不能用$HCl$调节$pH$探究$Fe^{3+}$显色的原因,D错误;故答案选D。
1. (2025·陕晋青宁卷)某实验室制备糖精钴$[Co(Sac)_{2}(H_{2}O)_{4}]· xH_{2}O$,并测定其结晶水含量。
已知:$Sac^{-}$表示糖精根离子,其摩尔质量为$182\ g·mol^{-1}$;糖精钴的溶解度在热水中较大,在冷水中较小;丙酮沸点为$56\ ^{\circ}C$,与水互溶。
$CoCl_{2}·6H_{2}O+2NaSac·2H_{2}O=[Co(Sac)_{2}(H_{2}O)_{4}]· xH_{2}O+(6 - x)H_{2}O+2NaCl$
(一)制备
Ⅰ. 称取$1.0\ g\ CoCl_{2}·6H_{2}O$,加入$18\ mL$蒸馏水,搅拌溶解,得溶液$1$。
Ⅱ. 称取$2.6\ g$(稍过量)糖精钠$(NaSac·2H_{2}O)$,加入$10\ mL$蒸馏水,加热搅拌,得溶液$2$。
Ⅲ. 将溶液$2$加入到接近沸腾的溶液$1$中,反应$3$分钟后停止加热,静置,冷却结晶。
Ⅳ. 过滤,依次用三种不同试剂洗涤晶体,晾干得产品。
回答下列问题:
(1) Ⅰ和Ⅱ中除烧杯外,还需用到的玻璃仪器有
(2) Ⅲ中静置过程有少量晶体出现时,可将烧杯置于
(3) Ⅳ中用①丙酮、②冷水、③冷的$1\%\ NaSac$溶液洗涤晶体,正确顺序为
A. ①③②
B. ③②①
C. ②①③
(4) Ⅳ中为了确认氯离子已经洗净,取水洗时的最后一次滤液于试管中,
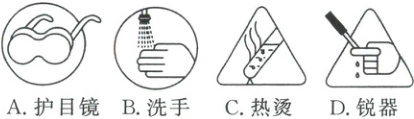
(5) 与本实验安全注意事项有关的图标有
(二)结晶水含量测定
$EDTA$和$Co^{2 + }$形成$1:1$配合物。准确称取$m\ g$糖精钴产品于锥形瓶中,加蒸馏水,加热溶解,再加入缓冲溶液和指示剂,在$50~60\ ^{\circ}C$下,用$c\ mol·L^{-1}$的$EDTA$标准溶液滴定。
(6) 下列操作的正确顺序为
a. 用标准溶液润洗滴定管
b. 加入标准溶液至“$0$”刻度以上$2~3\ mL$处
c. 检查滴定管是否漏水并清洗
d. 赶出气泡,调节液面,准确记录读数
(7) 滴定终点时消耗标准溶液$V\ mL$,则产品$[Co(Sac)_{2}(H_{2}O)_{4}]· xH_{2}O$中$x$的测定值为
已知:$Sac^{-}$表示糖精根离子,其摩尔质量为$182\ g·mol^{-1}$;糖精钴的溶解度在热水中较大,在冷水中较小;丙酮沸点为$56\ ^{\circ}C$,与水互溶。
$CoCl_{2}·6H_{2}O+2NaSac·2H_{2}O=[Co(Sac)_{2}(H_{2}O)_{4}]· xH_{2}O+(6 - x)H_{2}O+2NaCl$
(一)制备
Ⅰ. 称取$1.0\ g\ CoCl_{2}·6H_{2}O$,加入$18\ mL$蒸馏水,搅拌溶解,得溶液$1$。
Ⅱ. 称取$2.6\ g$(稍过量)糖精钠$(NaSac·2H_{2}O)$,加入$10\ mL$蒸馏水,加热搅拌,得溶液$2$。
Ⅲ. 将溶液$2$加入到接近沸腾的溶液$1$中,反应$3$分钟后停止加热,静置,冷却结晶。
Ⅳ. 过滤,依次用三种不同试剂洗涤晶体,晾干得产品。
回答下列问题:
(1) Ⅰ和Ⅱ中除烧杯外,还需用到的玻璃仪器有
玻璃棒、量筒
(写出两种)。(2) Ⅲ中静置过程有少量晶体出现时,可将烧杯置于
冰水
中,以使大量晶体析出。(3) Ⅳ中用①丙酮、②冷水、③冷的$1\%\ NaSac$溶液洗涤晶体,正确顺序为
B
。A. ①③②
B. ③②①
C. ②①③
(4) Ⅳ中为了确认氯离子已经洗净,取水洗时的最后一次滤液于试管中,
加入硝酸酸化的$AgNO_3$溶液,没有白色沉淀生成,说明氯离子已经洗净
(将实验操作、现象和结论补充完整)。(5) 与本实验安全注意事项有关的图标有
ABC
。
(二)结晶水含量测定
$EDTA$和$Co^{2 + }$形成$1:1$配合物。准确称取$m\ g$糖精钴产品于锥形瓶中,加蒸馏水,加热溶解,再加入缓冲溶液和指示剂,在$50~60\ ^{\circ}C$下,用$c\ mol·L^{-1}$的$EDTA$标准溶液滴定。
(6) 下列操作的正确顺序为
$c→a→b→d$
(用字母排序)。a. 用标准溶液润洗滴定管
b. 加入标准溶液至“$0$”刻度以上$2~3\ mL$处
c. 检查滴定管是否漏水并清洗
d. 赶出气泡,调节液面,准确记录读数
(7) 滴定终点时消耗标准溶液$V\ mL$,则产品$[Co(Sac)_{2}(H_{2}O)_{4}]· xH_{2}O$中$x$的测定值为
$\frac{\frac{1000m}{cV}-495}{18}$(或$\frac{500m}{9cV}-27.5$)
(用含$m$、$c$、$V$的代数式表示);若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会导致$x$的测定值偏高
(填“偏高”“偏低”或“无影响”)。
答案:
1.
(1)玻璃棒、量筒、胶头滴管、酒精灯(写出两种即可)
(2)冰水
(3)B
(4)加入硝酸酸化的$AgNO_3$溶液,没有白色沉淀生成,说明氯离子已经洗净
(5)ABC
(6)$c→a→b→d$
(7)$\frac{\frac{1000m}{cV}-495}{18}$(或$\frac{500m}{9cV}-27.5$) 偏高
解析:
(1)Ⅰ和Ⅱ步骤中,在烧杯中搅拌溶解固体需要用到玻璃棒,量取$10mL$或$18mL$蒸馏水需要用到量筒,量取蒸馏水定容时需要使用胶头滴管,加热时需要用到酒精灯。
(2)根据已知信息“糖精钴的溶解度在热水中较大,在冷水中较小”,故Ⅲ中静置过程有少量晶体出现时,可将烧杯置于冰水中,以使大量晶体析出。
(3)Ⅳ中洗涤时先用③冷的$1\%$ $NaSac$溶液洗涤晶体以除去晶体表面的可溶性杂质并减少其溶解损失,再用②冷水洗涤以除去晶体表面的$NaSac$,最后用①丙酮洗涤晶体以除去晶体表面的水,丙酮沸点较低,便于晾干,故B正确。
(4)Ⅳ中为了确认氯离子已经洗净,可取水洗时的最后一次滤液于试管中,加入硝酸酸化的$AgNO_3$溶液,没有白色沉淀生成,说明氯离子已经洗净。
(5)实验步骤Ⅲ中“将溶液2加入到接近沸腾的溶液1中”,为防止液体飞溅造成伤害,需要佩戴护目镜(A)、防止热烫(C),钴离子是重金属离子,实验完毕应注意洗手(B)。故与本实验安全注意事项有关的图标有ABC。
(6)将$c mol· L^{-1}$的EDTA标准溶液装入滴定管进行滴定操作时,需先检查滴定管是否漏水,滴定管确定可用后用水清洗,然后用标准溶液润洗滴定管,防止标准溶液被稀释,之后加入标准溶液至“0”刻度以上2~3mL处,最后赶出气泡,调节液面至“0”刻度或“0”刻度以下,准确记录初始读数。故顺序是$c→a→b→d$。
(7)根据“EDTA和$Co^{2+}$形成$1:1$配合物”可知,$n\{[Co(Sac)_2(H_2O)_4]· xH_2O\}=n(EDTA)=c mol· L^{-1}× V×10^{-3}L=cV×10^{-3}mol=\frac{m}{(495 + 18x)g· mol^{-1}}$,解得$x=\frac{\frac{1000m}{cV}-495}{18}$(或$x=\frac{500m}{9cV}-27.5$)。若滴定前滴定管尖嘴处无气泡,滴定后有气泡,则滴定终点时读数偏小,读取的标准溶液的体积偏小,结合$x$的计算式可知,$V$偏小会导致$x$的测定值偏高。
(1)玻璃棒、量筒、胶头滴管、酒精灯(写出两种即可)
(2)冰水
(3)B
(4)加入硝酸酸化的$AgNO_3$溶液,没有白色沉淀生成,说明氯离子已经洗净
(5)ABC
(6)$c→a→b→d$
(7)$\frac{\frac{1000m}{cV}-495}{18}$(或$\frac{500m}{9cV}-27.5$) 偏高
解析:
(1)Ⅰ和Ⅱ步骤中,在烧杯中搅拌溶解固体需要用到玻璃棒,量取$10mL$或$18mL$蒸馏水需要用到量筒,量取蒸馏水定容时需要使用胶头滴管,加热时需要用到酒精灯。
(2)根据已知信息“糖精钴的溶解度在热水中较大,在冷水中较小”,故Ⅲ中静置过程有少量晶体出现时,可将烧杯置于冰水中,以使大量晶体析出。
(3)Ⅳ中洗涤时先用③冷的$1\%$ $NaSac$溶液洗涤晶体以除去晶体表面的可溶性杂质并减少其溶解损失,再用②冷水洗涤以除去晶体表面的$NaSac$,最后用①丙酮洗涤晶体以除去晶体表面的水,丙酮沸点较低,便于晾干,故B正确。
(4)Ⅳ中为了确认氯离子已经洗净,可取水洗时的最后一次滤液于试管中,加入硝酸酸化的$AgNO_3$溶液,没有白色沉淀生成,说明氯离子已经洗净。
(5)实验步骤Ⅲ中“将溶液2加入到接近沸腾的溶液1中”,为防止液体飞溅造成伤害,需要佩戴护目镜(A)、防止热烫(C),钴离子是重金属离子,实验完毕应注意洗手(B)。故与本实验安全注意事项有关的图标有ABC。
(6)将$c mol· L^{-1}$的EDTA标准溶液装入滴定管进行滴定操作时,需先检查滴定管是否漏水,滴定管确定可用后用水清洗,然后用标准溶液润洗滴定管,防止标准溶液被稀释,之后加入标准溶液至“0”刻度以上2~3mL处,最后赶出气泡,调节液面至“0”刻度或“0”刻度以下,准确记录初始读数。故顺序是$c→a→b→d$。
(7)根据“EDTA和$Co^{2+}$形成$1:1$配合物”可知,$n\{[Co(Sac)_2(H_2O)_4]· xH_2O\}=n(EDTA)=c mol· L^{-1}× V×10^{-3}L=cV×10^{-3}mol=\frac{m}{(495 + 18x)g· mol^{-1}}$,解得$x=\frac{\frac{1000m}{cV}-495}{18}$(或$x=\frac{500m}{9cV}-27.5$)。若滴定前滴定管尖嘴处无气泡,滴定后有气泡,则滴定终点时读数偏小,读取的标准溶液的体积偏小,结合$x$的计算式可知,$V$偏小会导致$x$的测定值偏高。
查看更多完整答案,请扫码查看


