2026年学易优高考二轮总复习化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年学易优高考二轮总复习化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第80页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. (2025·山东滨州二模)过硫酸铵$[H_{4}NO-S-O-O-S-ONH_{4}]$在工业上有广泛用途,某兴趣小组根据反应$H_{2}O_{2}+2H_{2}SO_{4}(浓)+2NH_{3}=(NH_{4})_{2}S_{2}O_{8}+2H_{2}O$制备$(NH_{4})_{2}S_{2}O_{8}$粗品。回答下列问题:
(1) $(NH_{4})_{2}S_{2}O_{8}$中硫元素的化合价为
(2) 制备$(NH_{4})_{2}S_{2}O_{8}$时,从下列装置中根据需要选择组装。仪器的连接顺序为$c\to$
(3) 充分反应后,将$A$中的混合液经一系列操作得到晶体。烘干晶体时,采用减压、低温的原因是
(4) 采用碘量法测定$(NH_{4})_{2}S_{2}O_{8}$粗品的纯度。
称取$1.500\ g$制得的粗品,配成$100.00\ mL$溶液。移取$25.00\ mL$溶液于锥形瓶中,加入过量$KI$溶液,用标准浓度的$Na_{2}S_{2}O_{3}$溶液滴定(发生反应:$I_{2}+2S_{2}O_{3}^{2 - }=2I^{-}+S_{4}O_{6}^{2 - }$),当溶液颜色变浅时加入几滴淀粉溶液,滴定至终点。重复上述滴定操作三次,平均消耗$0.2000\ mol·L^{-1}$的$Na_{2}S_{2}O_{3}$溶液$12.50\ mL$。
①滴定终点的现象为
②$(NH_{4})_{2}S_{2}O_{8}$粗品的纯度为


(1) $(NH_{4})_{2}S_{2}O_{8}$中硫元素的化合价为
+6
。(2) 制备$(NH_{4})_{2}S_{2}O_{8}$时,从下列装置中根据需要选择组装。仪器的连接顺序为$c\to$
$g→f→b→a$
$\to$尾气处理,$D$装置的作用为防止装置A中液体倒吸入装置B中
,仪器$M$的名称为恒压滴液漏斗
。(3) 充分反应后,将$A$中的混合液经一系列操作得到晶体。烘干晶体时,采用减压、低温的原因是
降低烘干温度,防止$(NH_4)_2S_2O_8$分解
。(4) 采用碘量法测定$(NH_{4})_{2}S_{2}O_{8}$粗品的纯度。
称取$1.500\ g$制得的粗品,配成$100.00\ mL$溶液。移取$25.00\ mL$溶液于锥形瓶中,加入过量$KI$溶液,用标准浓度的$Na_{2}S_{2}O_{3}$溶液滴定(发生反应:$I_{2}+2S_{2}O_{3}^{2 - }=2I^{-}+S_{4}O_{6}^{2 - }$),当溶液颜色变浅时加入几滴淀粉溶液,滴定至终点。重复上述滴定操作三次,平均消耗$0.2000\ mol·L^{-1}$的$Na_{2}S_{2}O_{3}$溶液$12.50\ mL$。
①滴定终点的现象为
当滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟不恢复原色
。②$(NH_{4})_{2}S_{2}O_{8}$粗品的纯度为
76
$\%$。若开始滴定前加入淀粉溶液,则所测$(NH_{4})_{2}S_{2}O_{8}$的纯度偏高
(填“偏高”、“偏低”或“无影响”)。

答案:
1.
(1)+6
(2)$g→f→b→a$ 防止装置A中液体倒吸入装置B中 恒压滴液漏斗
(3)降低烘干温度,防止$(NH_4)_2S_2O_8$分解
(4)①当滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟不恢复原色
②76 偏高
解析:装置B用于制取氨气,制取氨气的原料为氢氧化钙固体和氯化铵固体,A装置为过二硫酸铵的生成装置,考虑氨气极易溶于水,需要在A、B之间放置安全瓶D以防止倒吸,最后用盛放碱石灰的干燥管C进行尾气处理,以此解答。
(1)过硫酸铵的结构简式为$H_4NO - S - O - O - S - ONH_4$,其中过氧键($-O - O -$)中$O$原子化合价为$-1$价,其它$O$原子化合价为$-2$价,铵根离子中$N$为$-3$价,$H$为$+1$价,根据化合物中各元素化合价代数和为零可知硫元素的化合价为$+6$;
(2)由分析可知,制备氨气后无需干燥,但需要防止倒吸,所以仪器的连接顺序为$c→g→f→b→a→$尾气处理;氨气极易溶于水,A、B之间放置安全瓶D以防止倒吸,则D装置的作用为防止装置A中液体倒吸入装置B中;由仪器构造可知,仪器M的名称为恒压滴液漏斗;
(3)$(NH_4)_2S_2O_8$受热会分解,则烘干产品时,采用减压、低温的原因是:降低烘干温度,防止$(NH_4)_2S_2O_8$受热分解;
(4)①移取$25.00mL(NH_4)_2S_2O_8$溶液于锥形瓶中,加入过量$KI$溶液,两者反应生成$I_2$,再用标准浓度的$Na_2S_2O_3$溶液滴定生成的$I_2$,当溶液颜色变浅时加入几滴淀粉溶液,此时溶液呈蓝色,用$Na_2S_2O_3$溶液滴定时发生反应:$I_2 + 2S_2O_3^{2 - } = 2I^ - + S_4O_6^{2 - }$,溶液的蓝色逐渐变浅,最终褪色,则滴定终点的现象为:当滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟不恢复原色;
②移取$25.00mL(NH_4)_2S_2O_8$溶液于锥形瓶中,加入过量$KI$溶液,两者反应生成$I_2$,再用标准浓度的$Na_2S_2O_3$溶液滴定生成的$I_2$,根据得失电子守恒可得关系式:$S_2O_8^{2 - }~I_2~2S_2O_3^{2 - }$,平均消耗$0.2000mol· L^{-1}$的$Na_2S_2O_3$溶液$12.50mL$,则$(NH_4)_2S_2O_8$粗品的纯度为$\frac{0.0125L×0.2000mol· L^{-1}×\frac{1}{2}×\frac{100mL}{25mL}×228g/mol}{1.500g}×100\% = 76\%$。如果在滴定前加入淀粉溶液,会导致淀粉与$I_2$结合生成性质稳定的蓝色络合物,这种络合物不易与$Na_2S_2O_3$反应,导致滴定终点拖后,消耗了更多的$Na_2S_2O_3$溶液,使结果偏高。
1.
(1)+6
(2)$g→f→b→a$ 防止装置A中液体倒吸入装置B中 恒压滴液漏斗
(3)降低烘干温度,防止$(NH_4)_2S_2O_8$分解
(4)①当滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟不恢复原色
②76 偏高
解析:装置B用于制取氨气,制取氨气的原料为氢氧化钙固体和氯化铵固体,A装置为过二硫酸铵的生成装置,考虑氨气极易溶于水,需要在A、B之间放置安全瓶D以防止倒吸,最后用盛放碱石灰的干燥管C进行尾气处理,以此解答。
(1)过硫酸铵的结构简式为$H_4NO - S - O - O - S - ONH_4$,其中过氧键($-O - O -$)中$O$原子化合价为$-1$价,其它$O$原子化合价为$-2$价,铵根离子中$N$为$-3$价,$H$为$+1$价,根据化合物中各元素化合价代数和为零可知硫元素的化合价为$+6$;
(2)由分析可知,制备氨气后无需干燥,但需要防止倒吸,所以仪器的连接顺序为$c→g→f→b→a→$尾气处理;氨气极易溶于水,A、B之间放置安全瓶D以防止倒吸,则D装置的作用为防止装置A中液体倒吸入装置B中;由仪器构造可知,仪器M的名称为恒压滴液漏斗;
(3)$(NH_4)_2S_2O_8$受热会分解,则烘干产品时,采用减压、低温的原因是:降低烘干温度,防止$(NH_4)_2S_2O_8$受热分解;
(4)①移取$25.00mL(NH_4)_2S_2O_8$溶液于锥形瓶中,加入过量$KI$溶液,两者反应生成$I_2$,再用标准浓度的$Na_2S_2O_3$溶液滴定生成的$I_2$,当溶液颜色变浅时加入几滴淀粉溶液,此时溶液呈蓝色,用$Na_2S_2O_3$溶液滴定时发生反应:$I_2 + 2S_2O_3^{2 - } = 2I^ - + S_4O_6^{2 - }$,溶液的蓝色逐渐变浅,最终褪色,则滴定终点的现象为:当滴入最后半滴标准液时,溶液由蓝色变为无色,且半分钟不恢复原色;
②移取$25.00mL(NH_4)_2S_2O_8$溶液于锥形瓶中,加入过量$KI$溶液,两者反应生成$I_2$,再用标准浓度的$Na_2S_2O_3$溶液滴定生成的$I_2$,根据得失电子守恒可得关系式:$S_2O_8^{2 - }~I_2~2S_2O_3^{2 - }$,平均消耗$0.2000mol· L^{-1}$的$Na_2S_2O_3$溶液$12.50mL$,则$(NH_4)_2S_2O_8$粗品的纯度为$\frac{0.0125L×0.2000mol· L^{-1}×\frac{1}{2}×\frac{100mL}{25mL}×228g/mol}{1.500g}×100\% = 76\%$。如果在滴定前加入淀粉溶液,会导致淀粉与$I_2$结合生成性质稳定的蓝色络合物,这种络合物不易与$Na_2S_2O_3$反应,导致滴定终点拖后,消耗了更多的$Na_2S_2O_3$溶液,使结果偏高。

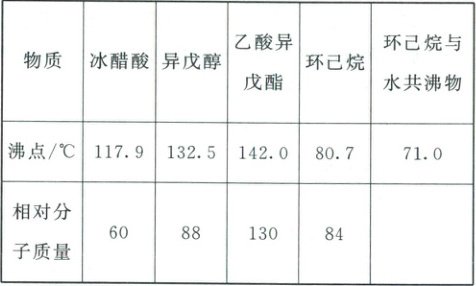
2. (2025·河南郑州二模)乙酸异戊酯在常温下是具有香蕉味的无色液体,常用于香精添加剂,其制取反应为$(CH_{3})_{2}CHCH_{2}CH_{2}OH+CH_{3}COOH\xrightarrow{H^{+}}CH_{3}COOCH_{2}CH_{2}CH(CH_{3})_{2}+H_{2}O$。相关物质的沸点及相对分子质量如下表:
制备步骤:
Ⅰ. 向如图烧瓶$a$中依次加入$4.85\ g$异戊醇、$3.60\ g$冰醋酸、$10\ mL$磷酸、$25\ mL$环己烷。
Ⅱ. 装上$b$、$c$装置,开动搅拌器,加热,使反应液回流$1.5\ h$。
Ⅲ. 把步骤Ⅱ的反应液转移至分液漏斗中,用$25\ mL$水洗涤一次,再用$NaHCO_{3}$溶液洗涤至中性,最后再用$5\ mL$饱和食盐水洗涤一次。
Ⅳ. 加入无水硫酸镁、过滤,然后将所得粗酯进行蒸馏,控制温度,先收集一种油状液体,然后再收集$138~142\ ^{\circ}C$的馏分$4.72\ g$。
完成下列问题:

(1) 选用$a$仪器的规格是$mL$(填选项字母)。
A. $50$
B. $100$
C. $250$
D. $500$
(2) 加入环己烷的作用是________,$b$仪器的作用是________。用磷酸而不用浓硫酸作催化剂的原因是________。
(3) $c$装置的作用是________。
(4) 步骤Ⅲ中用$NaHCO_{3}$溶液洗涤的作用是________,证明已经洗涤至中性的操作是________。
(5) 步骤Ⅲ中用饱和食盐水洗涤的目的是。
(6) 乙酸异戊酯的产率为。

制备步骤:
Ⅰ. 向如图烧瓶$a$中依次加入$4.85\ g$异戊醇、$3.60\ g$冰醋酸、$10\ mL$磷酸、$25\ mL$环己烷。
Ⅱ. 装上$b$、$c$装置,开动搅拌器,加热,使反应液回流$1.5\ h$。
Ⅲ. 把步骤Ⅱ的反应液转移至分液漏斗中,用$25\ mL$水洗涤一次,再用$NaHCO_{3}$溶液洗涤至中性,最后再用$5\ mL$饱和食盐水洗涤一次。
Ⅳ. 加入无水硫酸镁、过滤,然后将所得粗酯进行蒸馏,控制温度,先收集一种油状液体,然后再收集$138~142\ ^{\circ}C$的馏分$4.72\ g$。
完成下列问题:

(1) 选用$a$仪器的规格是$mL$(填选项字母)。
A. $50$
B. $100$
C. $250$
D. $500$
(2) 加入环己烷的作用是________,$b$仪器的作用是________。用磷酸而不用浓硫酸作催化剂的原因是________。
(3) $c$装置的作用是________。
(4) 步骤Ⅲ中用$NaHCO_{3}$溶液洗涤的作用是________,证明已经洗涤至中性的操作是________。
(5) 步骤Ⅲ中用饱和食盐水洗涤的目的是。
(6) 乙酸异戊酯的产率为。
答案:
2.
(1)B
(2)作溶剂 分离出水,提高乙酸异戊酯的产率 在浓硫酸存在时,醇可发生消去反应和分子间脱水反应;浓硫酸使有机物炭化
(3)冷凝回流冰醋酸、环己烷等有机物,提高乙酸异戊酯产率
(4)除去磷酸与醋酸 用玻璃棒蘸取洗涤液,点在pH试纸上,变色后与标准比色卡比对$pH = 7$
(5)除去$NaHCO_3$
(6)66%或0.66
解析:
(1)仪器a是圆底烧瓶,圆底烧瓶内液体的体积大于烧瓶容积的$\frac{1}{3}$小于$\frac{2}{3}$,加试剂的体积约$35mL$,选用圆底烧瓶的规格是$100mL$,选B。
(2)加入环己烷作溶剂,使反应物充分混合,加快反应速率,反应更充分;b是分水器,b仪器的作用是分离出水,提高乙酸异戊酯的产率。在浓硫酸存在时,醇可发生消去反应和分子间脱水反应,浓硫酸能使有机物炭化,所以用磷酸而不用浓硫酸作催化剂。
(3)c是球形冷凝管,c装置的作用是冷凝回流冰醋酸、环己烷等有机物,提高乙酸异戊酯产率。
(4)碳酸氢钠能与酸反应,步骤Ⅲ中用$NaHCO_3$溶液洗涤的作用是除去磷酸与醋酸;用玻璃棒蘸取洗涤液,点在pH试纸上,变色后与标准比色卡比对$pH = 7$,证明已经洗涤至中性。
(5)步骤Ⅲ中用饱和食盐水洗涤的目的是降低酯的溶解度除去$NaHCO_3$
(6)$4.85g$异戊醇的物质的量为$0.055mol$、$3.60g$冰醋酸的物质的量为$0.06mol$,理论上生成$0.055mol$乙酸异戊酯,产率为$\frac{4.72g}{0.055mol×130g/mol}×100\% = 66\%$。
(1)B
(2)作溶剂 分离出水,提高乙酸异戊酯的产率 在浓硫酸存在时,醇可发生消去反应和分子间脱水反应;浓硫酸使有机物炭化
(3)冷凝回流冰醋酸、环己烷等有机物,提高乙酸异戊酯产率
(4)除去磷酸与醋酸 用玻璃棒蘸取洗涤液,点在pH试纸上,变色后与标准比色卡比对$pH = 7$
(5)除去$NaHCO_3$
(6)66%或0.66
解析:
(1)仪器a是圆底烧瓶,圆底烧瓶内液体的体积大于烧瓶容积的$\frac{1}{3}$小于$\frac{2}{3}$,加试剂的体积约$35mL$,选用圆底烧瓶的规格是$100mL$,选B。
(2)加入环己烷作溶剂,使反应物充分混合,加快反应速率,反应更充分;b是分水器,b仪器的作用是分离出水,提高乙酸异戊酯的产率。在浓硫酸存在时,醇可发生消去反应和分子间脱水反应,浓硫酸能使有机物炭化,所以用磷酸而不用浓硫酸作催化剂。
(3)c是球形冷凝管,c装置的作用是冷凝回流冰醋酸、环己烷等有机物,提高乙酸异戊酯产率。
(4)碳酸氢钠能与酸反应,步骤Ⅲ中用$NaHCO_3$溶液洗涤的作用是除去磷酸与醋酸;用玻璃棒蘸取洗涤液,点在pH试纸上,变色后与标准比色卡比对$pH = 7$,证明已经洗涤至中性。
(5)步骤Ⅲ中用饱和食盐水洗涤的目的是降低酯的溶解度除去$NaHCO_3$
(6)$4.85g$异戊醇的物质的量为$0.055mol$、$3.60g$冰醋酸的物质的量为$0.06mol$,理论上生成$0.055mol$乙酸异戊酯,产率为$\frac{4.72g}{0.055mol×130g/mol}×100\% = 66\%$。
查看更多完整答案,请扫码查看


