第79页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
3.在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:$3A(g)+B(g)\rightleftharpoons xC(g)+2D(g)$。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为$0.2mol·L^{-1}$。下列判断正确的是 (C)
A.$x = 2$
B.B的转化率为50%
C.2 min内A的平均反应速率为$0.3mol·L^{-1}·min^{-1}$
D.若混合气体的密度保持不变,则表明该反应达到平衡状态
A.$x = 2$
B.B的转化率为50%
C.2 min内A的平均反应速率为$0.3mol·L^{-1}·min^{-1}$
D.若混合气体的密度保持不变,则表明该反应达到平衡状态
答案:
C [A项,2 min末测得C的浓度为0.2 mol·L⁻¹,则生成C的物质的量为0.2 mol·L⁻¹×2 L=0.4 mol,根据方程式可知:x∶2=0.4 mol∶0.8 mol,所以x=1;B项,根据三段式计算:
3A(g)+B(g)$\rightleftharpoons$C(g)+2D(g)
起始(mol/L) 1.5 0.5 0 0
转化(mol/L) 0.6 0.2 0.2 0.4
平衡(mol/L) 0.9 0.3 0.2 0.4
据以上分析可知,B的转化率=$\frac{0.2 mol·L⁻¹}{0.5 mol·L⁻¹}$×100%=40%;C项,2 min内A的平均反应速率=$\frac{0.6 mol·L⁻¹}{2 min}$=0.3 mol·(L·min)⁻¹;D项,因反应前后各物质均为气态,则反应前后气体的质量不变化,而反应容器的容积是固定的,则混合气体的密度在反应过程中是不变的。]
4.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体体积忽略不计),在恒定温度下使其达到分解平衡:$NH_{2}COONH_{4}(s)\rightleftharpoons2NH_{3}(g)+CO_{2}(g)$,不能判断该分解反应达到化学平衡的是 (B)
A.混合气体的压强不再变化
B.密闭容器中氨的体积分数不变
C.混合气体的密度不再变化
D.混合气体的总物质的量不再变化
A.混合气体的压强不再变化
B.密闭容器中氨的体积分数不变
C.混合气体的密度不再变化
D.混合气体的总物质的量不再变化
答案:
B [A项,该反应为气体物质的量增大的反应,混合气体的压强为变量,混合气体的压强不再变化时,表明达到平衡状态;B项,氨和二氧化碳的化学计量数之比为2∶1,故密闭容器中氨的体积分数始终保持不变,故不能作为判断是否达到化学平衡状态的依据;C项,NH₂COONH₄(s)为固态,混合气体的总质量为变量,总体积为定值,则混合气体的密度为变量,当混合气体的密度不再变化时,表明达到平衡状态;D项,该反应为气体物质的量增大的反应,混合气体的总物质的量不再变化时,表明达到平衡状态。]
5.一定温度下,在一容积不变的密闭容器中发生反应:$2SO_{2}(g)+O_{2}(g)\rightleftharpoons2SO_{3}(g)$。已知反应过程中某时刻,$SO_{2}$、$O_{2}$、$SO_{3}$的物质的量浓度分别为2 mol/L、1 mol/L、2 mol/L。当反应达到平衡时,可能的数据是 (B)
①$SO_{2}$为4 mol/L
②$SO_{3}$为3.5 mol/L
③$SO_{2}$、$SO_{3}$均为1.5 mol/L
④$O_{2}$为0.5 mol/L
A.①②
B.②③
C.①③
D.②④
①$SO_{2}$为4 mol/L
②$SO_{3}$为3.5 mol/L
③$SO_{2}$、$SO_{3}$均为1.5 mol/L
④$O_{2}$为0.5 mol/L
A.①②
B.②③
C.①③
D.②④
答案:
D [根据可逆反应的理解,已知反应过程中某时刻,SO₂、O₂、SO₃的物质的量浓度分别为2 mol/L、1 mol/L、2 mol/L,假设SO₃全部转化,则生成的SO₂、O₂的物质的量浓度分别为2 mol/L、1 mol/L,所以达到平衡时,SO₂、O₂的物质的量浓度范围分别为0<c(SO₂)<4 mol/L,0<c(O₂)<2 mol/L,同理可得SO₃的平衡浓度为0<c(SO₃)<4 mol/L,据此分析解答。①根据上述分析可知,SO₂的平衡浓度为0<c(SO₂)<4 mol/L,所以SO₂的物质的量浓度达不到4 mol/L;②根据上述分析可知,SO₃的平衡浓度为0<c(SO₃)<4 mol/L,所以SO₃的物质的量浓度达不到4 mol/L;③当SO₂浓度为1.5 mol/L时,消耗的SO₂浓度为(2-1.5) mol/L=0.5 mol/L,则转化生成的SO₃浓度为(2+0.5) mol/L=2.5 mol/L;④根据上述分析可知,平衡时O₂的物质的量浓度范围为0<c(O₂)<2 mol/L,所以其浓度可以为0.5 mol/L。]
6.一定条件下,等物质的量的$N_{2}$和$O_{2}$在容积为4 L的恒容密闭容器中发生如下反应:$N_{2}(g)+O_{2}(g)\rightleftharpoons2NO(g)$。如图表示该反应过程中$N_{2}$的物质的量$n(N_{2})$随反应时间(t)的变化。下列叙述正确的是(C)
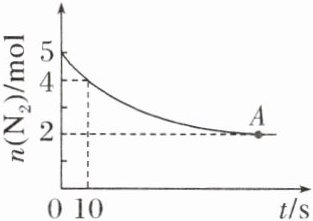
A.当反应达到平衡时,$O_{2}$的转化率为60%
B.10 s内反应的平均速率为$v(N_{2}) = 0.1mol·L^{-1}·s^{-1}$
C.10 s末NO的物质的量浓度为$1mol·L^{-1}$
D.A点对应的化学反应速率:$v_{正}(N_{2}) = v_{逆}(NO)$

A.当反应达到平衡时,$O_{2}$的转化率为60%
B.10 s内反应的平均速率为$v(N_{2}) = 0.1mol·L^{-1}·s^{-1}$
C.10 s末NO的物质的量浓度为$1mol·L^{-1}$
D.A点对应的化学反应速率:$v_{正}(N_{2}) = v_{逆}(NO)$
答案:
A [A项,由题图可知,反应达到平衡时,N₂由5 mol变为2 mol,由于N₂和O₂起始加入量相同,且又是等物质的量反应,则O₂的转化率为$\frac{3 mol}{5 mol}$×100%=60%;B项,10 s内消耗(5-4) mol N₂,则10 s内v(N₂)=$\frac{(5 - 4) mol}{4 L×10 s}$=0.025 mol·L⁻¹·s⁻¹;C项,10 s末时生成2 mol NO,则此时c(NO)=$\frac{2 mol}{4 L}$=0.5 mol·L⁻¹;D项,A点达到平衡状态,则2v₍正₎(N₂)=v₍逆₎(NO)。]
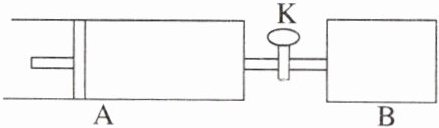
7.如图,向A、B中均充入1 mol X、1 mol Y,起始时A、B的体积相等都等于a L。在相同温度、压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:$X(g)+Y(g)\rightleftharpoons2Z(g)+W(g)$ $\Delta H<0$。达平衡时,A的体积为1.4a L。下列说法错误的是 (C)
A.反应速率:$v_{B}>v_{A}$
B.A容器中X的转化率为80%
C.平衡时的压强:$p_{B}=p_{A}$
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率

A.反应速率:$v_{B}>v_{A}$
B.A容器中X的转化率为80%
C.平衡时的压强:$p_{B}=p_{A}$
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
答案:
C [对于X(g)+Y(g)$\rightleftharpoons$2Z(g)+W(g)来说,正反应是气体物质的量增大的反应,A、B容器分别在恒压、恒容下建立平衡。平衡之前,由于B的气体压强增大,根据压强对化学反应速率的影响可知,每个时刻的反应速率B都将大于A容器,即反应速率:vB>vA,A正确;根据阿伏加德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2 mol=2.8 mol,即增大了0.8 mol,根据化学方程式的计算可知,
X(g)+Y(g)$\rightleftharpoons$2Z(g)+W(g) △n
1 1
0.8 mol 0.8 mol
即达平衡后,X反应掉0.8 mol,A容器中X的转化率为80%,B正确;从反应开始至达到平衡,反应体系的压强B>A,C错误;由于A是恒压条件下进行反应,平衡时向A容器中充入与反应无关的气体M,使体系的压强增大,则容器的容积扩大,使反应混合物中各组分的物质的量浓度减小,化学反应速率减慢,D正确。]
查看更多完整答案,请扫码查看


