第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
4.稀硝酸的还原产物可以是NO、N₂O、N₂、NH₄NO₃。在稀硝酸和Zn的反应中,硝酸既体现了酸性又体现了氧化性。若有10个HNO₃参加反应,则有8个电子转移,由此推断稀硝酸的还原产物可能为(D)
①NO ②N₂O ③N₂ ④NH₄NO₃
A.①②
B.②③
C.①③
D.②④
①NO ②N₂O ③N₂ ④NH₄NO₃
A.①②
B.②③
C.①③
D.②④
答案:
D [在稀硝酸和$Zn$的反应中,硝酸既体现了酸性又体现了氧化性。若有10个$HNO_{3}$参加反应,有8个电子转移,则生成4个$Zn(NO_{3})_{2}$,用掉8个$HNO_{3}$,若余下的2个$HNO_{3}$中$N$元素化合价都发生改变,则每个$N$原子由+5价降低到+1价,从而得出还原产物为$N_{2}O$,若余下的2个$HNO_{3}$中只有1个$N$原子价态降低,则由+5价降低到 - 3价,还原产物为$NH_{4}NO_{3}$,由此推断稀$HNO_{3}$的还原产物可能为$N_{2}O$或$NH_{4}NO_{3}$。]
5.下列有关实验操作、现象和解释或结论都正确的是(B)
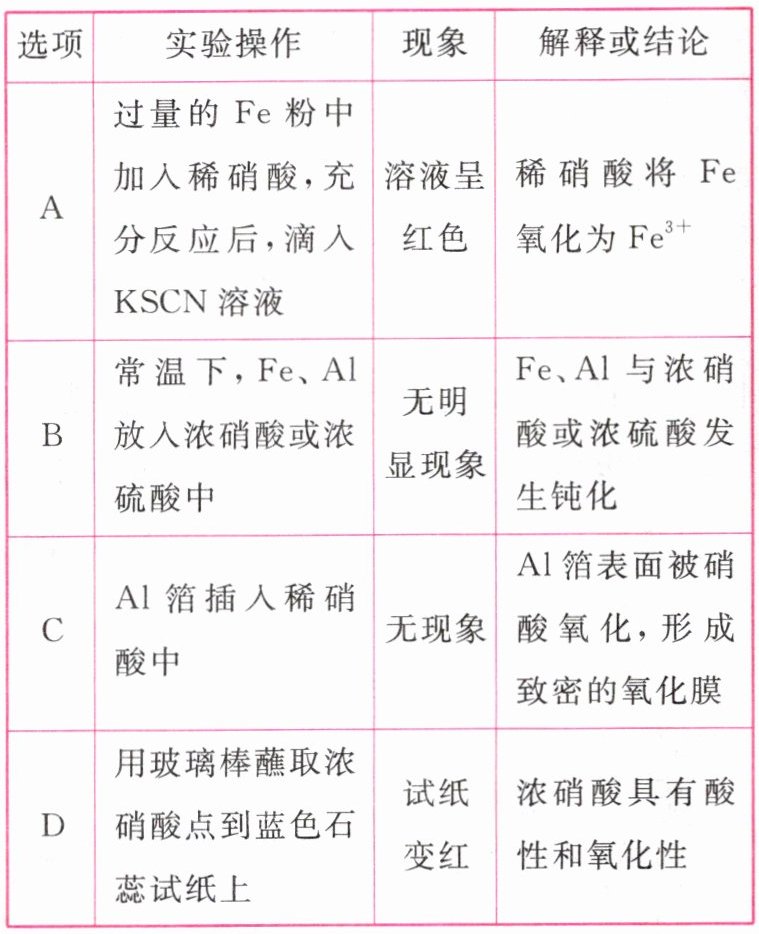

答案:
B [稀硝酸与铁粉反应,铁首先被氧化成$Fe^{3+}$,过量铁粉将$Fe^{3+}$还原,最终得到$Fe^{2+}$,滴入$KSCN$溶液不显红色,A项错误;常温下,$Fe$、$Al$在浓硝酸或浓硫酸中发生钝化,生成致密的氧化物保护膜阻止了反应进行,B项正确;$Al$箔能与稀硝酸反应放出气体,C项错误;浓硝酸具有强氧化性,点到蓝色石蕊试纸上,一段时间后会褪色。]
6.某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是(B)
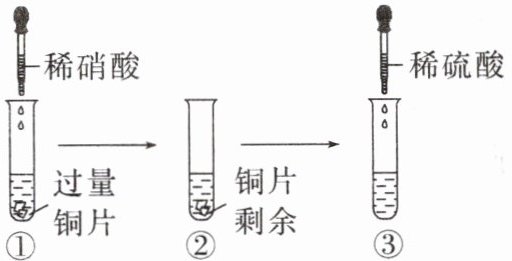
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO₂
B.若③中加入足量稀硫酸,则在相同条件下①中产生的气体体积比③中产生的气体体积小
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应

A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO₂
B.若③中加入足量稀硫酸,则在相同条件下①中产生的气体体积比③中产生的气体体积小
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
答案:
B [A项,①中发生反应:$3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O$,生成硝酸铜溶液为蓝色,在试管口$NO$遇空气,与空气中的$O_{2}$发生反应生成$NO_{2}$,使气体由无色变为红棕色,但硝酸被还原生成的是无色的$NO$;B项,实验①中发生反应$3Cu + 8H^{+}+2NO_{3}^{-}=3Cu^{2+}+2NO\uparrow +4H_{2}O$,假设①中加入溶液中含有8 mol $HNO_{3}$,则产生2 mol $NO$气体;实验③发生反应的化学方程式为$3Cu + 8H^{+}+2NO_{3}^{-}=3Cu^{2+}+2NO\uparrow +4H_{2}O$,反应产生的3 mol $Cu(NO_{3})_{2}$电离产生6 mol $NO_{3}^{-}$完全反应后会生成6 mol $NO$,故若③中加入足量稀硫酸,则在相同条件下①中产生的气体体积比③中产生的气体体积小;C项,③中加稀硫酸,金属$Cu$会溶解,不是因为$Cu$与稀硫酸反应,而是由于硝酸铜电离产生的$NO_{3}^{-}$与硫酸电离产生的$H^{+}$起$HNO_{3}$的作用,表现强氧化性,继续与$Cu$反应,说明硝酸的氧化性强;D项,由上述实验可得出结论:$Cu$在常温下可以和稀硝酸反应,但不能与稀硫酸反应。]
7.对于反应3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂ + 2NO↑ + 4H₂O,下列叙述正确的是(C)
A.氧化剂和还原剂的物质的量之比为8∶3
B.被还原的HNO₃和起酸性作用的HNO₃的物质的量之比为3∶1
C.生成1mol NO转移的电子数为3Nₐ
D.该反应中Cu(NO₃)₂为氧化产物,H₂O为还原产物
A.氧化剂和还原剂的物质的量之比为8∶3
B.被还原的HNO₃和起酸性作用的HNO₃的物质的量之比为3∶1
C.生成1mol NO转移的电子数为3Nₐ
D.该反应中Cu(NO₃)₂为氧化产物,H₂O为还原产物
答案:
C [A项,$3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O$中,$Cu$元素化合价由0价变为+2价,$N$元素化合价由+5价变为+2价,所以铜作还原剂,硝酸作氧化剂,参加反应的硝酸中有$\frac{1}{4}$被还原,所以氧化剂和还原剂的物质的量之比是2 : 3;B项,该反应中参加反应的硝酸中有$\frac{1}{4}$被还原,所以被还原的$HNO_{3}$和起酸性作用的$HNO_{3}$的物质的量的比为1 : 3;C项,该反应中转移电子数$=3×(2 - 0)=2×(5 - 2)=6$,结合方程式可知生成1 mol $NO$转移的电子数为$3N_{A}$;D项,该反应中,铜作还原剂,则硝酸铜是氧化产物,部分硝酸作氧化剂,所以$NO$是还原产物。]
8.某100mL混合液中,HNO₃和H₂SO₄的物质的量浓度分别是0.4mol·L⁻¹和0.1mol·L⁻¹,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中Cu²⁺的物质的量浓度(忽略体积变化)为(A)
A.0.15mol·L⁻¹
B.0.225mol·L⁻¹
C.0.35mol·L⁻¹
D.0.45mol·L⁻¹
A.0.15mol·L⁻¹
B.0.225mol·L⁻¹
C.0.35mol·L⁻¹
D.0.45mol·L⁻¹
答案:
B
9.向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列说法错误的是(D)
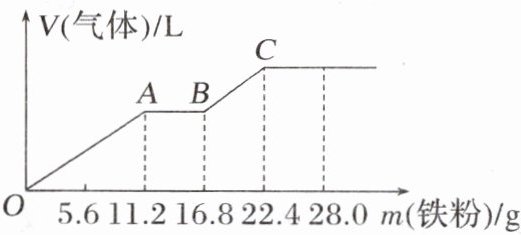
A.OA段产生的气体是NO
B.A点溶液中的溶质为Fe(NO₃)₃和H₂SO₄
C.原混合溶液中NO₃⁻的物质的量为0.2mol
D.原混合溶液中H₂SO₄的物质的量浓度为2.0mol·L⁻¹

A.OA段产生的气体是NO
B.A点溶液中的溶质为Fe(NO₃)₃和H₂SO₄
C.原混合溶液中NO₃⁻的物质的量为0.2mol
D.原混合溶液中H₂SO₄的物质的量浓度为2.0mol·L⁻¹
答案:
B [根据题图像,$OA$段发生反应$Fe + 4H^{+}+NO_{3}^{-}=Fe^{3+}+2H_{2}O + NO\uparrow$、$AB$段发生反应$2Fe^{3+}+Fe = 3Fe^{2+}$、$BC$段发生反应$Fe + 2H^{+}=Fe^{2+}+H_{2}\uparrow$。A项,$OA$段发生反应$Fe + 4H^{+}+NO_{3}^{-}=Fe^{3+}+2H_{2}O + NO\uparrow$,$OA$段产生的是$NO$;B项,$A$点溶液中加入铁粉不再生成$NO$气体,所以溶液中不含$NO_{3}^{-}$,溶质为$Fe_{2}(SO_{4})_{3}$和$H_{2}SO_{4}$;C项,$OA$段发生反应$Fe + 4H^{+}+NO_{3}^{-}=Fe^{3+}+2H_{2}O + NO\uparrow$,消耗$Fe$为$\frac{11.2 g}{56 g/mol}=0.2$ mol,所以原混合溶液中$NO_{3}^{-}$的物质的量为0.2 mol;D项,加入22.4 g $Fe$粉后,溶液中的溶质完全是$FeSO_{4}$,根据$S$元素守恒,原混合溶液中$H_{2}SO_{4}$的物质的量浓度为$\frac{22.4 g}{56 g/mol}\div0.2 L = 2.0 mol\cdot L^{-1}$。]
查看更多完整答案,请扫码查看


