第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
1. 下列关于氮气性质的说法中正确的是(D)
A. 点燃条件下,N₂在氧气中燃烧生成NO
B. 点燃时,N₂与金属Mg反应生成Mg₃N₂,N₂作还原剂
C. 合成氨反应中,N₂发生氧化反应
D. 氮气的化学性质稳定,其原因是两个氮原子之间以共价三键结合
A. 点燃条件下,N₂在氧气中燃烧生成NO
B. 点燃时,N₂与金属Mg反应生成Mg₃N₂,N₂作还原剂
C. 合成氨反应中,N₂发生氧化反应
D. 氮气的化学性质稳定,其原因是两个氮原子之间以共价三键结合
答案:
D [A项,氮气在放电或高温条件下生成一氧化氮;B项,点燃时,$N_{2}$与金属Mg反应生成$Mg_{3}N_{2}$,$N_{2}$得电子化合价降低作氧化剂;C项,合成氨反应中,$N_{2}$得电子化合价降低发生还原反应;D项,氮气的化学性质稳定,其原因是两个氮原子之间以共价三键结合,键能大,不易断裂,物质的化学性质稳定。]
2. 下列关于NO和NO₂的说法中正确的是(D)
A. NO₂是红棕色气体,易溶于水,属于酸性氧化物
B. NO₂可由N₂和O₂直接化合得到
C. NO和NO₂均既可以用排空气法收集又可以用排水法收集
D. NO和NO₂在一定条件下可以相互转化
A. NO₂是红棕色气体,易溶于水,属于酸性氧化物
B. NO₂可由N₂和O₂直接化合得到
C. NO和NO₂均既可以用排空气法收集又可以用排水法收集
D. NO和NO₂在一定条件下可以相互转化
答案:
D [A选项,$NO_{2}$不是酸性氧化物;B选项,在高温或放电条件下,$N_{2}$和$O_{2}$直接化合生成NO;C选项,NO易与空气中的氧气反应生成$NO_{2}$,只能用排水法收集,$NO_{2}$能与水反应,只能用排空气法收集;D选项,NO和氧气反应生成$NO_{2}$,$NO_{2}$与水反应生成$HNO_{3}$和NO。]
3. 下列关于氮的氧化物的叙述正确的是(C)
A. 氮的氧化物只有NO、NO₂
B. 氮的氧化物均为红棕色气体
C. 氮的氧化物均有毒
D. 氮的氧化物在空气中均能稳定存在
A. 氮的氧化物只有NO、NO₂
B. 氮的氧化物均为红棕色气体
C. 氮的氧化物均有毒
D. 氮的氧化物在空气中均能稳定存在
答案:
C [氮的氧化物包括NO、$N_{2}O$、$NO_{2}$、$N_{2}O_{3}$、$N_{2}O_{4}$、$N_{2}O_{5}$等,A项错误;NO、$N_{2}O_{4}$等均为无色气体,B项错误;氮的氧化物均有毒,C项正确;NO在空气中易被$O_{2}$氧化为$NO_{2}$,D项错误。]
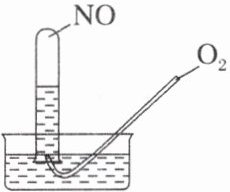
4. 按图进行实验。试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O₂,下列是有关最终状态的描述:
①试管内气体呈棕色 ②试管内气体呈无色 ③试管内液面不变 ④试管内液面上升 ⑤试管内气体是O₂ ⑥试管内气体是NO,其中正确的是(C)
A. ①③
B. ②④⑤
C. ②④⑥
D. ②③⑤
①试管内气体呈棕色 ②试管内气体呈无色 ③试管内液面不变 ④试管内液面上升 ⑤试管内气体是O₂ ⑥试管内气体是NO,其中正确的是(C)

A. ①③
B. ②④⑤
C. ②④⑥
D. ②③⑤
答案:
C [根据$4NO + 3O_{2}+2H_{2}O = 4HNO_{3}$可得,剩余气体应为NO,体积为$\frac{4}{3}$mL,试管内液面上升。]
5. 如图为雷雨时节,雨水中硝酸的形成过程。回答下列有关问题:
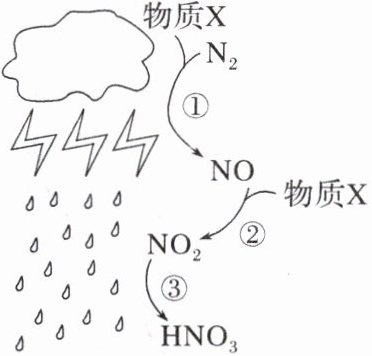
(1)图中物质X为O₂(填化学式),转化①、②、③中属于氮的固定的是①。
(2)NO₂与水蒸气反应生成稀硝酸的化学方程式为3NO₂ + H₂O = 2HNO₃ + NO;该反应中氧化剂与还原剂的物质的量之比为1∶2。
(3)俗话说“雷雨发庄稼”,一些植物的根可以将空气中的N₂转化为NH₃,与雨水中的HNO₃反应,形成氮肥。这种氮肥加热至230℃分解,产生两种常温下无污染的气体,该反应的化学方程式为NH₄NO₃$\stackrel{230℃}{=\!=\!=}$N₂O↑ + 2H₂O↑。
(4)将容积为50 mL,充满O₂和NO₂气体的试管倒扣在装满水的水槽中,试管内液面上升,最终有5 mL气体剩余,假设反应前后试管内气体压强和温度均不变,则反应前试管内O₂和NO₂的体积比可能为2∶13或1∶9(写出所有可能的答案)。

(1)图中物质X为O₂(填化学式),转化①、②、③中属于氮的固定的是①。
(2)NO₂与水蒸气反应生成稀硝酸的化学方程式为3NO₂ + H₂O = 2HNO₃ + NO;该反应中氧化剂与还原剂的物质的量之比为1∶2。
(3)俗话说“雷雨发庄稼”,一些植物的根可以将空气中的N₂转化为NH₃,与雨水中的HNO₃反应,形成氮肥。这种氮肥加热至230℃分解,产生两种常温下无污染的气体,该反应的化学方程式为NH₄NO₃$\stackrel{230℃}{=\!=\!=}$N₂O↑ + 2H₂O↑。
(4)将容积为50 mL,充满O₂和NO₂气体的试管倒扣在装满水的水槽中,试管内液面上升,最终有5 mL气体剩余,假设反应前后试管内气体压强和温度均不变,则反应前试管内O₂和NO₂的体积比可能为2∶13或1∶9(写出所有可能的答案)。
答案:
解析
(1) 氮气和氧气放电条件下合成一氧化氮,故X为$O_{2}$;氮的固定为游离态的氮变为化合态的氮的过程,故属于氮的固定的为①。
(2) 二氧化氮和水生成硝酸和一氧化氮,反应方程式为$3NO_{2}+H_{2}O = 2HNO_{3}+NO$;该反应中3 mol二氧化氮中有2 mol生成硝酸,作还原剂,有1 mol生成一氧化氮,作氧化剂,故氧化剂与还原剂的物质的量之比为1∶2。
(3) 氨气和硝酸生成氮肥硝酸铵,加热分解生成两种无污染的气体氮气和氧气,故化学方程式为$2NH_{4}NO_{3}\xlongequal{230^{\circ}C}O_{2}\uparrow+2N_{2}\uparrow+4H_{2}O$。
(4) 若NO剩余,则首先发生反应$4NO_{2}+O_{2}+2H_{2}O = 4HNO_{3}$,然后剩余的二氧化氮继续反应$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,最终NO是5 mL,则剩余的$NO_{2}$是15 mL。所以另外35 mL气体是$NO_{2}$和$O_{2}$按照体积比4∶1进行反应,其中28 mL是二氧化氮,7 mL是氧气,所以二氧化氮共计43 mL,氧气7 mL,则$O_{2}$和$NO_{2}$的体积比为7∶43;若$O_{2}$剩余,剩余$O_{2}$ 5 mL,则另外45 mL气体是$NO_{2}$和$O_{2}$按照体积比4∶1进行反应,其中36 mL是二氧化氮,9 mL是氧气,所以二氧化氮36 mL,氧气共计14 mL,则$O_{2}$和$NO_{2}$的体积比为7∶18。 答案
(1)$O_{2}$ ①
(2)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ 1∶2
(3)$2NH_{4}NO_{3}\xlongequal{230^{\circ}C}O_{2}\uparrow+2N_{2}\uparrow+4H_{2}O$
(4)7∶18或7∶43
(1) 氮气和氧气放电条件下合成一氧化氮,故X为$O_{2}$;氮的固定为游离态的氮变为化合态的氮的过程,故属于氮的固定的为①。
(2) 二氧化氮和水生成硝酸和一氧化氮,反应方程式为$3NO_{2}+H_{2}O = 2HNO_{3}+NO$;该反应中3 mol二氧化氮中有2 mol生成硝酸,作还原剂,有1 mol生成一氧化氮,作氧化剂,故氧化剂与还原剂的物质的量之比为1∶2。
(3) 氨气和硝酸生成氮肥硝酸铵,加热分解生成两种无污染的气体氮气和氧气,故化学方程式为$2NH_{4}NO_{3}\xlongequal{230^{\circ}C}O_{2}\uparrow+2N_{2}\uparrow+4H_{2}O$。
(4) 若NO剩余,则首先发生反应$4NO_{2}+O_{2}+2H_{2}O = 4HNO_{3}$,然后剩余的二氧化氮继续反应$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,最终NO是5 mL,则剩余的$NO_{2}$是15 mL。所以另外35 mL气体是$NO_{2}$和$O_{2}$按照体积比4∶1进行反应,其中28 mL是二氧化氮,7 mL是氧气,所以二氧化氮共计43 mL,氧气7 mL,则$O_{2}$和$NO_{2}$的体积比为7∶43;若$O_{2}$剩余,剩余$O_{2}$ 5 mL,则另外45 mL气体是$NO_{2}$和$O_{2}$按照体积比4∶1进行反应,其中36 mL是二氧化氮,9 mL是氧气,所以二氧化氮36 mL,氧气共计14 mL,则$O_{2}$和$NO_{2}$的体积比为7∶18。 答案
(1)$O_{2}$ ①
(2)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ 1∶2
(3)$2NH_{4}NO_{3}\xlongequal{230^{\circ}C}O_{2}\uparrow+2N_{2}\uparrow+4H_{2}O$
(4)7∶18或7∶43
查看更多完整答案,请扫码查看


