第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
9.$NH_{3}$及铵盐都是重要的化工原料,在工业生产和生活中有广泛的应用。
(1)氨的制备
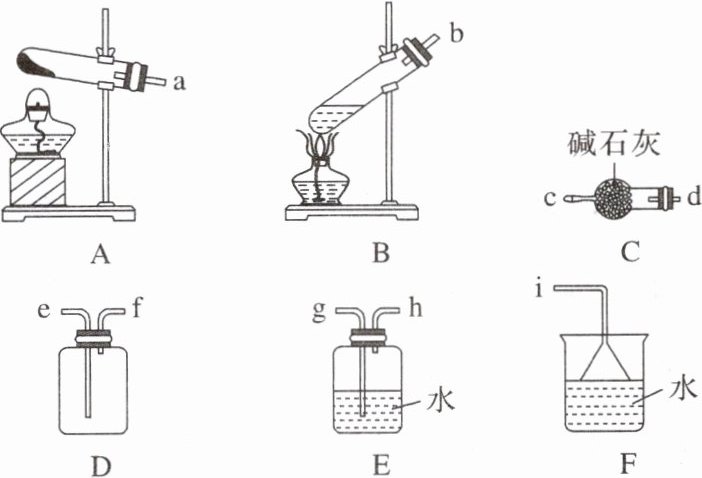
①制备氨的发生装置可以选择图中的|A或B|
反应的化学方程式为|$2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2} + 2NH_{3}\uparrow + 2H_{2}O$(A装置对应)或$NH_{3}\cdot H_{2}O\xlongequal{\triangle}NH_{3}\uparrow + H_{2}O$(B装置对应)
②欲收集一瓶干燥的氨,选择图中的装置,其连接顺序为发生装置→|d→c→f→e→i
(2)按如图装置进行$NH_{3}$性质实验。
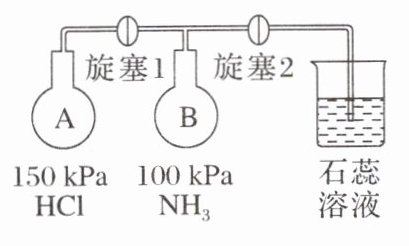
①先打开旋塞1,B瓶中的现象是|产生大量白烟
原因是|A瓶中$HCl$与B瓶中$NH_{3}$反应生成$NH_{4}Cl$固体小颗粒
稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是|烧杯中的石蕊溶液倒吸入B瓶,溶液变蓝色
(3)氮的氧化物($NO_{x}$)是大气污染物之一,工业上在一定温度和催化剂条件下$NH_{3}$将$NO_{2}$转化为无污染的$N_{2}$,写出其反应的化学方程式|$8NH_{3}+6NO_{2}\xlongequal{催化剂}7N_{2}+12H_{2}O$
(1)氨的制备

①制备氨的发生装置可以选择图中的|A或B|
反应的化学方程式为|$2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2} + 2NH_{3}\uparrow + 2H_{2}O$(A装置对应)或$NH_{3}\cdot H_{2}O\xlongequal{\triangle}NH_{3}\uparrow + H_{2}O$(B装置对应)
②欲收集一瓶干燥的氨,选择图中的装置,其连接顺序为发生装置→|d→c→f→e→i
(2)按如图装置进行$NH_{3}$性质实验。

①先打开旋塞1,B瓶中的现象是|产生大量白烟
原因是|A瓶中$HCl$与B瓶中$NH_{3}$反应生成$NH_{4}Cl$固体小颗粒
稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是|烧杯中的石蕊溶液倒吸入B瓶,溶液变蓝色
(3)氮的氧化物($NO_{x}$)是大气污染物之一,工业上在一定温度和催化剂条件下$NH_{3}$将$NO_{2}$转化为无污染的$N_{2}$,写出其反应的化学方程式|$8NH_{3}+6NO_{2}\xlongequal{催化剂}7N_{2}+12H_{2}O$
答案:
解析:熟石灰和氯化铵加热反应生成氯化钙和氨,氨用碱石灰干燥后,使用向下排空气法收集,尾气吸收处理。(1)①制备氨一般用熟石灰和氯化铵加热反应生成氯化钙、氨和水,发生装置可以选择图中的A,反应的化学方程式为$2NH_{4}Cl+Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2}+2NH_{3}\uparrow+2H_{2}O$或选B加热浓氨水,方程式为$NH_{3}\cdot H_{2}O(浓)\xlongequal{\triangle}NH_{3}\uparrow+H_{2}O$。②氨密度小于空气,极易溶于水,可以选择碱石灰干燥剂(大口进小口出)并使用向上排空气法(D装置中氨要短进长出)收集一瓶干燥的氨,尾气有毒需要使用F进行尾气处理(倒置的漏斗可以防止倒吸),故图中的装置顺序为ACDF或BCDF,其接口连接顺序为发生装置→adcf ei或bdcf ei;(2)①A中压强较大,B中压强较小,先打开旋塞1,氯化氢气体进入B中和氨反应生成氯化铵固体,故B瓶中的现象是产生大量的白烟。②反应后B中气体反应压强减小,根据阿伏加德罗定律可知,氯化氢的量较多,反应后氯化氢过量,氯化氢水溶液显酸性,再打开旋塞2,石蕊溶液进入B,B瓶中的现象是溶液变红色;(3)在一定温度和催化剂条件下$NH_{3}$和$NO_{2}$转化为无污染的$N_{2}$,同时根据质量守恒可知还会生成水,$8NH_{3}+6NO_{2}\xlongequal[\triangle]{催化剂}7N_{2}+12H_{2}O$。
答案:(1)①A或B,$2NH_{4}Cl+Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2}+2NH_{3}\uparrow+2H_{2}O$或$NH_{3}\cdot H_{2}O(浓)\xlongequal{\triangle}NH_{3}\uparrow+H_{2}O$(合理即可)
②adcf ei或bdcf ei
(2)①产生大量的白烟,A中压强较大,B中压强较小,先打开旋塞1,氯化氢气体进入B中和氨反应生成氯化铵固体
②溶液变红色
(3)$8NH_{3}+6NO_{2}\xlongequal[\triangle]{催化剂}7N_{2}+12H_{2}O$
10.某化学兴趣小组为了制取并探究氨的性质,按下列装置(部分夹持装置已略去)进行实验。
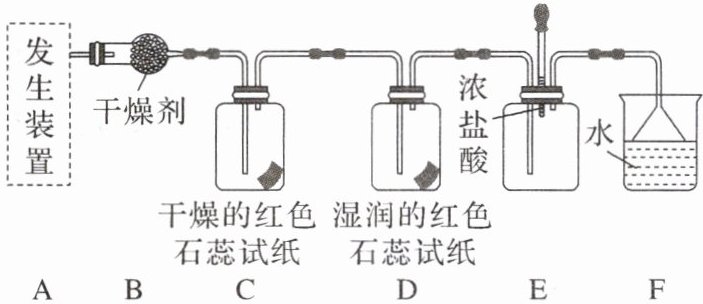
|(1)用5.35 g $NH_{4}Cl$固体与足量$Ca(OH)_{2}$反应,最多可制得标准状况下氨的体积为|2.24|
|(2)B装置中的干燥剂可选用|碱石灰|
|F装置的作用为|吸收多余的氨气,防止污染空气|
|(3)气体通过C、D装置时,试纸颜色会发生变化的是|D|
|原因是|氨气与水反应生成$NH_{3}\cdot H_{2}O$,$NH_{3}\cdot H_{2}O$电离出$OH^{-}$使溶液显碱性,湿润的红色石蕊试纸遇碱变蓝|
|(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是|产生大量白烟|
|(5)在B、C装置间增加一个集气瓶可用于收集氨。检验氨是否收集满的方法是|将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则说明已收集满;或用蘸有浓盐酸的玻璃棒靠近集气瓶口,若产生白烟,则说明已收集满|
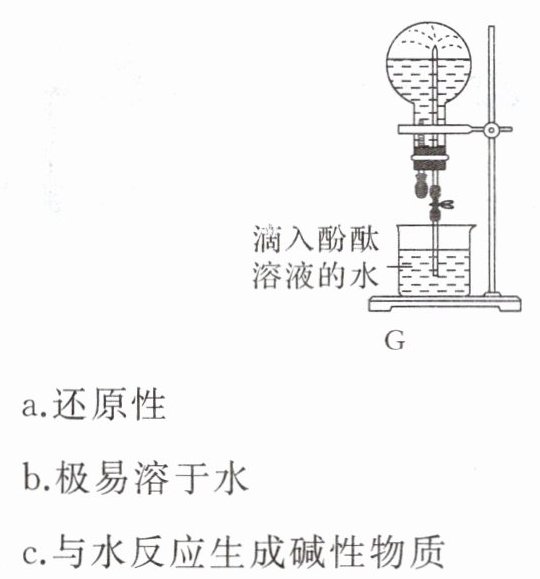
|(6)某同学用如图G所示装置进行氨的性质实验(烧杯中滴加了酚酞溶液),根据烧瓶内产生红色喷泉的现象,说明氨具有的性质|b、c|

|(1)用5.35 g $NH_{4}Cl$固体与足量$Ca(OH)_{2}$反应,最多可制得标准状况下氨的体积为|2.24|
|(2)B装置中的干燥剂可选用|碱石灰|
|F装置的作用为|吸收多余的氨气,防止污染空气|
|(3)气体通过C、D装置时,试纸颜色会发生变化的是|D|
|原因是|氨气与水反应生成$NH_{3}\cdot H_{2}O$,$NH_{3}\cdot H_{2}O$电离出$OH^{-}$使溶液显碱性,湿润的红色石蕊试纸遇碱变蓝|
|(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是|产生大量白烟|
|(5)在B、C装置间增加一个集气瓶可用于收集氨。检验氨是否收集满的方法是|将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则说明已收集满;或用蘸有浓盐酸的玻璃棒靠近集气瓶口,若产生白烟,则说明已收集满|
|(6)某同学用如图G所示装置进行氨的性质实验(烧杯中滴加了酚酞溶液),根据烧瓶内产生红色喷泉的现象,说明氨具有的性质|b、c|

答案:
解析:$NH_{4}Cl$固体与足量$Ca(OH)_{2}$发生反应制取氨,用碱石灰干燥氨,氨遇湿润的红色石蕊试纸会生成显碱性的一水合氨,试纸会变蓝色,干燥的试纸不变色,浓盐酸遇氨会生成氯化铵固体,出现白烟,氨极易溶于水,有毒会污染环境,应进行尾气吸收,而且要防倒吸。(1)$NH_{4}Cl$固体与足量$Ca(OH)_{2}$发生反应$2NH_{4}Cl+Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2}+2NH_{3}\uparrow+2H_{2}O$,由$NH_{4}Cl\sim NH_{3}$,53.5 g对应22.4 L,5.35 g对应$V(NH_{3})$,得$V(NH_{3}) = 2.24L$;(2)B装置是为了干燥氨,干燥氨应该选碱性干燥剂,可选用碱石灰;氨极易溶于水,有刺激性气味,有毒会污染环境,应进行尾气吸收,而且要防倒吸,所以F的作用是吸收$NH_{3}$等尾气且防止倒吸;(3)干燥的氨不显碱性,不能使干燥的红色石蕊试纸变色,氨和水反应生成的一水合氨显碱性,可以使红色石蕊试纸变蓝色;(4)浓盐酸与氨反应会生成固体氯化铵,瓶中会出现白烟;(5)在B、C装置间增加一个集气瓶可用于收集氨,氨遇湿润的红色石蕊试纸会变蓝色,所以检验氨是否收集满的方法是用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满;(6)无色酚酞遇碱变红色,观察到美丽的红色喷泉,则氨与水反应生成碱性物质,氨极易溶于水而形成压强差,导致形成喷泉。
答案:(1)2.24
(2)碱石灰,吸收$NH_{3}$等尾气且防止倒吸
(3)氨与水反应生成一水合氨呈碱性
(4)E瓶中产生白烟
(5)用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满
(6)bc
查看更多完整答案,请扫码查看


