第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
8. 根据化学能转化为电能的相关知识,回答下列问题:
Ⅰ. 理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu + 2Fe³⁺ = 2Fe²⁺ + Cu²⁺”设计一种化学电池(正极材料用石墨棒),回答下列问题:
(1)该电池的负极材料是______(填化学式),发生______(填“氧化”或“还原”)反应,电解质溶液是______(填化学式)溶液。
(2)正极上发生的电极反应为______。
(3)若导线上转移的电子为1 mol,则消耗的金属铜的质量为______。
Ⅱ. 有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L⁻¹的H₂SO₄溶液中,乙同学将电极放入6 mol·L⁻¹的NaOH溶液中,如下图所示:
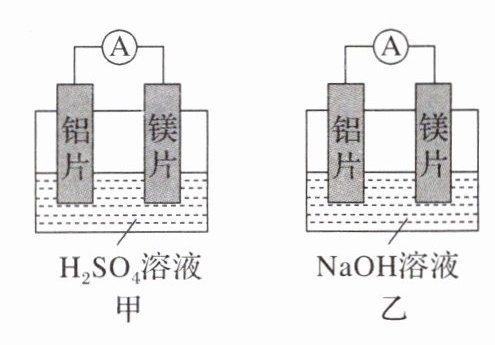
(4)写出甲池中的现象:______;负极的电极反应式:______。
(5)写出乙池中负极的电极材料和总反应的离子方程式:负极材料(化学式)______;总反应的离子方程式______。
(6)甲池溶液中阳离子的移动方向是______。乙池外电路中电子的流动方向是______。甲池中产生气泡的电极是______;乙池外电路中电流的方向是______。
(7)若甲与乙同学认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出______金属活动性更强,而乙会判断出______金属活动性更强。
(8)由此实验,可得到如下哪些正确结论______(填字母)。
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序已过时,已没有实用价值
D. 该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(9)丙同学依据甲、乙同学的思路,设计如下实验:
将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池,在这两个原电池中,负极分别为______(填字母序号)。
A. 铝片、铜片 B. 铜片、铝片
C. 铝片、铝片 D. 铜片、铜片
Ⅰ. 理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu + 2Fe³⁺ = 2Fe²⁺ + Cu²⁺”设计一种化学电池(正极材料用石墨棒),回答下列问题:
(1)该电池的负极材料是______(填化学式),发生______(填“氧化”或“还原”)反应,电解质溶液是______(填化学式)溶液。
(2)正极上发生的电极反应为______。
(3)若导线上转移的电子为1 mol,则消耗的金属铜的质量为______。
Ⅱ. 有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L⁻¹的H₂SO₄溶液中,乙同学将电极放入6 mol·L⁻¹的NaOH溶液中,如下图所示:

(4)写出甲池中的现象:______;负极的电极反应式:______。
(5)写出乙池中负极的电极材料和总反应的离子方程式:负极材料(化学式)______;总反应的离子方程式______。
(6)甲池溶液中阳离子的移动方向是______。乙池外电路中电子的流动方向是______。甲池中产生气泡的电极是______;乙池外电路中电流的方向是______。
(7)若甲与乙同学认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出______金属活动性更强,而乙会判断出______金属活动性更强。
(8)由此实验,可得到如下哪些正确结论______(填字母)。
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序已过时,已没有实用价值
D. 该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(9)丙同学依据甲、乙同学的思路,设计如下实验:
将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池,在这两个原电池中,负极分别为______(填字母序号)。
A. 铝片、铜片 B. 铜片、铝片
C. 铝片、铝片 D. 铜片、铜片
答案:
解析:原电池中首先考虑自发进行的氧化还原反应,再分析两极反应:负极发生失电子的氧化反应,正极发生得电子的还原反应,据此回答。Ⅰ.
(1)$Cu + 2Fe^{3+} = 2Fe^{2+} + Cu^{2+}$反应中,$Cu$元素化合价升高,发生氧化反应,$Cu$作负极,正极上,$Fe^{3+}$得电子生成$Fe^{2+}$,电解质溶液需要提供$Fe^{3+}$,故电解质溶液是$Fe_2(SO_4)_3$溶液或$FeCl_3$溶液;
(2)正极上,$Fe^{3+}$得电子生成$Fe^{2+}$,电极反应式为$Fe^{3+} + e^- = Fe^{2+}$;
(3)根据$Cu + 2Fe^{3+} = 2Fe^{2+} + Cu^{2+}$可知,转移1 mol电子,消耗0.5 mol Cu,则消耗的金属铜的质量为0.5 mol×64 g/mol = 32 g;Ⅱ.
(4)金属活动性:$Mg>Al$,电解质溶液为稀硫酸,$Mg$作负极,发生氧化反应生成$Mg^{2+}$,$Al$作正极,$H^+$发生还原反应生成$H_2$,故甲中的现象为镁片逐渐变薄,铝片表面有气泡产生,甲池中自发进行的氧化还原反应为$2H^+ + Mg = Mg^{2+} + H_2↑$,负极反应为$Mg - 2e^- = Mg^{2+}$;
(5)乙池中铝能与氢氧化钠溶液反应,铝失电子作负极,镁作正极,正极发生还原反应,总反应的离子方程式为$2Al + 2OH^- + 6H_2O = 2[Al(OH)_4]^- + 3H_2↑$;
(6)甲池溶液中$Mg$作负极、$Al$作正极,阳离子的移动方向是移向铝片;乙池中$Mg$作正极、$Al$作负极,电子从负极流向正极,外电路中电子的流动方向是铝片流向镁片;甲池中$Al$做正极,氢离子得电子生成氢气,产生气泡的电极是铝片;电流从正极流向负极,乙池外电路中电流的方向是镁片流向铝片;
(7)甲中镁作负极、乙中铝作负极,根据作负极的金属活动性强判断,则甲会判断出$Mg$活动性更强,而乙会判断出$Al$活动性更强;
(8)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,A正确;B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,B错误;C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,C错误;D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,因此应具体问题具体分析,D正确;
(9)将铝片和铜片用导线相连,插入浓硝酸中,铝片被钝化,铜片作负极;插入烧碱溶液中,铝失电子,作负极,故选B。 答案:Ⅰ.
(1)$Cu$,氧化,$Fe_2(SO_4)_3$(或$FeCl_3$)
(2)$Fe^{3+} + e^- = Fe^{2+}$
(3)32 g Ⅱ.
(4)镁片逐渐变薄,铝片表面有气泡产生,$Mg - 2e^- = Mg^{2+}$
(5)$Al$,$2Al + 2OH^- + 6H_2O = 2[Al(OH)_4]^- + 3H_2↑$
(6)移向铝片,铝片流向镁片,铝片,镁片流向铝片
(7)$Mg$,$Al$
(8)AD
(9)B
(1)$Cu + 2Fe^{3+} = 2Fe^{2+} + Cu^{2+}$反应中,$Cu$元素化合价升高,发生氧化反应,$Cu$作负极,正极上,$Fe^{3+}$得电子生成$Fe^{2+}$,电解质溶液需要提供$Fe^{3+}$,故电解质溶液是$Fe_2(SO_4)_3$溶液或$FeCl_3$溶液;
(2)正极上,$Fe^{3+}$得电子生成$Fe^{2+}$,电极反应式为$Fe^{3+} + e^- = Fe^{2+}$;
(3)根据$Cu + 2Fe^{3+} = 2Fe^{2+} + Cu^{2+}$可知,转移1 mol电子,消耗0.5 mol Cu,则消耗的金属铜的质量为0.5 mol×64 g/mol = 32 g;Ⅱ.
(4)金属活动性:$Mg>Al$,电解质溶液为稀硫酸,$Mg$作负极,发生氧化反应生成$Mg^{2+}$,$Al$作正极,$H^+$发生还原反应生成$H_2$,故甲中的现象为镁片逐渐变薄,铝片表面有气泡产生,甲池中自发进行的氧化还原反应为$2H^+ + Mg = Mg^{2+} + H_2↑$,负极反应为$Mg - 2e^- = Mg^{2+}$;
(5)乙池中铝能与氢氧化钠溶液反应,铝失电子作负极,镁作正极,正极发生还原反应,总反应的离子方程式为$2Al + 2OH^- + 6H_2O = 2[Al(OH)_4]^- + 3H_2↑$;
(6)甲池溶液中$Mg$作负极、$Al$作正极,阳离子的移动方向是移向铝片;乙池中$Mg$作正极、$Al$作负极,电子从负极流向正极,外电路中电子的流动方向是铝片流向镁片;甲池中$Al$做正极,氢离子得电子生成氢气,产生气泡的电极是铝片;电流从正极流向负极,乙池外电路中电流的方向是镁片流向铝片;
(7)甲中镁作负极、乙中铝作负极,根据作负极的金属活动性强判断,则甲会判断出$Mg$活动性更强,而乙会判断出$Al$活动性更强;
(8)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,A正确;B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,B错误;C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,C错误;D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,因此应具体问题具体分析,D正确;
(9)将铝片和铜片用导线相连,插入浓硝酸中,铝片被钝化,铜片作负极;插入烧碱溶液中,铝失电子,作负极,故选B。 答案:Ⅰ.
(1)$Cu$,氧化,$Fe_2(SO_4)_3$(或$FeCl_3$)
(2)$Fe^{3+} + e^- = Fe^{2+}$
(3)32 g Ⅱ.
(4)镁片逐渐变薄,铝片表面有气泡产生,$Mg - 2e^- = Mg^{2+}$
(5)$Al$,$2Al + 2OH^- + 6H_2O = 2[Al(OH)_4]^- + 3H_2↑$
(6)移向铝片,铝片流向镁片,铝片,镁片流向铝片
(7)$Mg$,$Al$
(8)AD
(9)B
查看更多完整答案,请扫码查看


