第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
12. 硅酸钠被列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程简图:
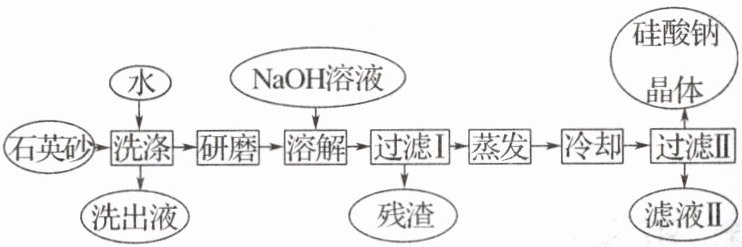
(1)要将洗出液中的溶质析出,采用的方法是蒸发结晶,则蒸发时用到的主要仪器有 蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈) 。
(2)图中加入$NaOH$溶液,发生反应的离子方程式为$SiO_2 + 2OH^ - = SiO_3^{2 - } + H_2O$。
(3)洗涤石英砂的目的是 除去石英砂中的氯化钠、氧化铁等杂质 ,过滤Ⅰ所得残渣为 Fe_2O_3 (写化学式)。

(1)要将洗出液中的溶质析出,采用的方法是蒸发结晶,则蒸发时用到的主要仪器有 蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈) 。
(2)图中加入$NaOH$溶液,发生反应的离子方程式为$SiO_2 + 2OH^ - = SiO_3^{2 - } + H_2O$。
(3)洗涤石英砂的目的是 除去石英砂中的氯化钠、氧化铁等杂质 ,过滤Ⅰ所得残渣为 Fe_2O_3 (写化学式)。
答案:
(1) 蒸发皿、玻璃棒、酒精灯、铁架台
(2) $\mathrm{SiO}_{2} + 2\mathrm{OH}^{-} \xlongequal{\;\;} \mathrm{SiO}_{3}^{2 - } + \mathrm{H}_{2}\mathrm{O}$
(3) 除去石英砂表面的氯化钠;$\mathrm{Fe}_{2}\mathrm{O}_{3}$
(1) 蒸发皿、玻璃棒、酒精灯、铁架台
(2) $\mathrm{SiO}_{2} + 2\mathrm{OH}^{-} \xlongequal{\;\;} \mathrm{SiO}_{3}^{2 - } + \mathrm{H}_{2}\mathrm{O}$
(3) 除去石英砂表面的氯化钠;$\mathrm{Fe}_{2}\mathrm{O}_{3}$
13. 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅的原子结构示意图为 +14 2 8 4 。现代通信材料石英光导纤维中含有 二氧化硅 。
(2)强碱缓慢腐蚀玻璃,盛强碱的试剂瓶瓶塞不能用玻璃塞的原因$SiO_2 + 2OH^ - = SiO_3^{2 - } + H_2O$(用离子方程式解释)。
(3)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把 光 能转化为 电 能的装置。
(4)工业上可以通过如图所示的流程制取高纯硅:
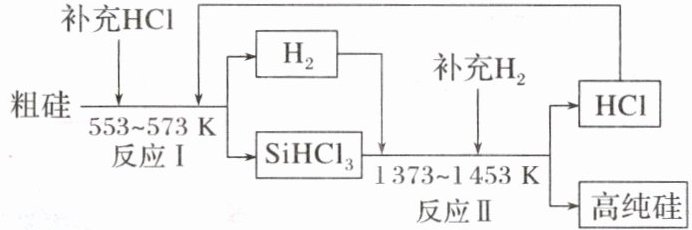
①若反应Ⅰ为$Si(粗) + 3HCl\xlongequal{553 - 573K}SiHCl_3 + H_2$,则反应Ⅱ的化学方程式为$SiHCl_3 + H_2\xlongequal{1373 - 1453K}Si + 3HCl$。
②整个制备过程必须严格控制无水无氧。$SiHCl_3$遇水剧烈反应生成$H_2SiO_3$、$HCl$和另一种物质,写出该反应的化学方程式:$SiHCl_3 + 3H_2O = H_2SiO_3↓ + 3HCl + H_2↑$。
③假设每一轮次制备1 mol高纯硅,且生产过程中硅元素没有损失,反应Ⅰ中$HCl$的利用率为90%,反应Ⅱ中$H_2$的利用率为93.75%,则在第二轮次的生产中,补充投入$HCl$和$H_2$的物质的量之比是 5∶1 。
(1)硅的原子结构示意图为 +14 2 8 4 。现代通信材料石英光导纤维中含有 二氧化硅 。
(2)强碱缓慢腐蚀玻璃,盛强碱的试剂瓶瓶塞不能用玻璃塞的原因$SiO_2 + 2OH^ - = SiO_3^{2 - } + H_2O$(用离子方程式解释)。
(3)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把 光 能转化为 电 能的装置。
(4)工业上可以通过如图所示的流程制取高纯硅:

①若反应Ⅰ为$Si(粗) + 3HCl\xlongequal{553 - 573K}SiHCl_3 + H_2$,则反应Ⅱ的化学方程式为$SiHCl_3 + H_2\xlongequal{1373 - 1453K}Si + 3HCl$。
②整个制备过程必须严格控制无水无氧。$SiHCl_3$遇水剧烈反应生成$H_2SiO_3$、$HCl$和另一种物质,写出该反应的化学方程式:$SiHCl_3 + 3H_2O = H_2SiO_3↓ + 3HCl + H_2↑$。
③假设每一轮次制备1 mol高纯硅,且生产过程中硅元素没有损失,反应Ⅰ中$HCl$的利用率为90%,反应Ⅱ中$H_2$的利用率为93.75%,则在第二轮次的生产中,补充投入$HCl$和$H_2$的物质的量之比是 5∶1 。
答案:
(1) <ImageHere1></Img>;$\mathrm{SiO}_{2}$
(2) $\mathrm{SiO}_{2} + 2\mathrm{OH}^{-} \xlongequal{\;\;} \mathrm{SiO}_{3}^{2 - } + \mathrm{H}_{2}\mathrm{O}$
(3) 光;电
(4) ①$\mathrm{SiHCl}_{3} + \mathrm{H}_{2} \xlongequal{1373~1453\ K} \mathrm{Si}$(纯)$ + 3\mathrm{HCl}$ ②$\mathrm{SiHCl}_{3} + 3\mathrm{H}_{2}\mathrm{O} \xlongequal{\;\;} \mathrm{H}_{2}\mathrm{SiO}_{3} + 3\mathrm{HCl} + \mathrm{H}_{2} \uparrow$ ③5 : 1
(1) <ImageHere1></Img>;$\mathrm{SiO}_{2}$
(2) $\mathrm{SiO}_{2} + 2\mathrm{OH}^{-} \xlongequal{\;\;} \mathrm{SiO}_{3}^{2 - } + \mathrm{H}_{2}\mathrm{O}$
(3) 光;电
(4) ①$\mathrm{SiHCl}_{3} + \mathrm{H}_{2} \xlongequal{1373~1453\ K} \mathrm{Si}$(纯)$ + 3\mathrm{HCl}$ ②$\mathrm{SiHCl}_{3} + 3\mathrm{H}_{2}\mathrm{O} \xlongequal{\;\;} \mathrm{H}_{2}\mathrm{SiO}_{3} + 3\mathrm{HCl} + \mathrm{H}_{2} \uparrow$ ③5 : 1
查看更多完整答案,请扫码查看


