第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
15. 如图所示,在B水槽中装有500 mL水,容积为a mL的试管A充满了NO₂和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中剩余气体的体积为0.5a mL。
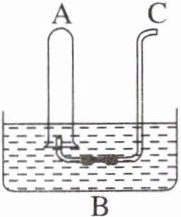
(1)将A倒插入B槽中发生的反应为3NO₂ + H₂O = 2HNO₃ + NO,该反应中氧化剂与还原剂的质量比为1∶2,原混合气体中NO₂和NO的物质的量之比为3∶1。
(2)通过导气管C向剩余0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是无色气体变为红棕色,红棕色气体又变为无色,液面不断上升直至充满试管。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为$\frac{a}{11200}$mol·L⁻¹(设溶液的体积仍为500 mL)。

(1)将A倒插入B槽中发生的反应为3NO₂ + H₂O = 2HNO₃ + NO,该反应中氧化剂与还原剂的质量比为1∶2,原混合气体中NO₂和NO的物质的量之比为3∶1。
(2)通过导气管C向剩余0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是无色气体变为红棕色,红棕色气体又变为无色,液面不断上升直至充满试管。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为$\frac{a}{11200}$mol·L⁻¹(设溶液的体积仍为500 mL)。
答案:
解析
(1) 试管A倒插入B水槽的水中后,发生反应:$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,氧化剂与还原剂均为$NO_{2}$,质量比为1∶2。根据题意有$\frac{1}{3}n(NO_{2})+n(NO)=\frac{1}{2}[n(NO_{2})+n(NO)]$,$n(NO_{2})∶n(NO)=3∶1$;
(2) 试管A中剩余0.5a mL气体为NO,通入氧气后,发生反应$2NO + O_{2}=2NO_{2}$,$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,可写为$4NO + 3O_{2}+2H_{2}O = 4HNO_{3}$,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体($O_{2}$)。
(3) 试管中充满气体时,根据氮原子守恒,$n(HNO_{3}) = n(气体)=\frac{a}{22.4}\times10^{-3}mol$,$c(HNO_{3})=\frac{\frac{a}{22.4}\times10^{-3}mol}{0.5 L}=\frac{a}{11200}mol\cdot L^{-1}$ 答案
(1)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ 1∶2 3∶1
(2) 无色气体变为红棕色,试管中液面不断上升至全充满。继续通入氧气后,试管中液面下降,最后充满无色气体
(3)$\frac{a}{11200}$
(1) 试管A倒插入B水槽的水中后,发生反应:$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,氧化剂与还原剂均为$NO_{2}$,质量比为1∶2。根据题意有$\frac{1}{3}n(NO_{2})+n(NO)=\frac{1}{2}[n(NO_{2})+n(NO)]$,$n(NO_{2})∶n(NO)=3∶1$;
(2) 试管A中剩余0.5a mL气体为NO,通入氧气后,发生反应$2NO + O_{2}=2NO_{2}$,$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,可写为$4NO + 3O_{2}+2H_{2}O = 4HNO_{3}$,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色气体($O_{2}$)。
(3) 试管中充满气体时,根据氮原子守恒,$n(HNO_{3}) = n(气体)=\frac{a}{22.4}\times10^{-3}mol$,$c(HNO_{3})=\frac{\frac{a}{22.4}\times10^{-3}mol}{0.5 L}=\frac{a}{11200}mol\cdot L^{-1}$ 答案
(1)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ 1∶2 3∶1
(2) 无色气体变为红棕色,试管中液面不断上升至全充满。继续通入氧气后,试管中液面下降,最后充满无色气体
(3)$\frac{a}{11200}$
16. 利用石灰乳和硝酸工业的尾气(含NO、NO₂)反应,既能净化尾气,又能获得应用广泛的Ca(NO₂)₂,其部分工艺流程如下:
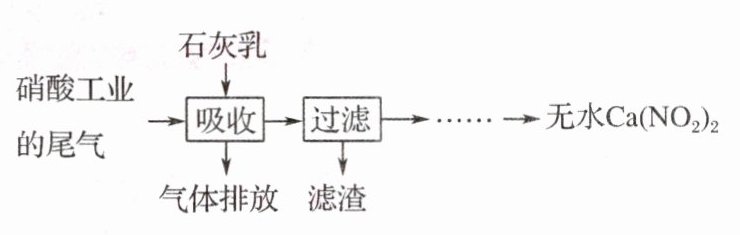
(1)一定条件下,NO与NO₂可以生成一种新的氧化物,试写出该反应的化学方程式:NO + NO₂$\stackrel{一定条件}{=\!=\!=}$N₂O₃。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是使尾气中的NO、NO₂被充分吸收;滤渣可循环使用,滤渣的主要成分是Ca(OH)₂(填化学式)。
(3)该工艺需控制NO和NO₂物质的量之比接近1∶1。若n(NO)∶n(NO₂)>1∶1,则会导致排放气体中NO含量升高;若n(NO)∶n(NO₂)<1∶1,则会导致产品Ca(NO₂)₂中Ca(NO₃)₂含量升高。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO₂)₂会发生分解,产物之一是NO,其反应的离子方程式为3NO₂⁻ + 2H⁺ = NO₃⁻ + 2NO↑ + H₂O。

(1)一定条件下,NO与NO₂可以生成一种新的氧化物,试写出该反应的化学方程式:NO + NO₂$\stackrel{一定条件}{=\!=\!=}$N₂O₃。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是使尾气中的NO、NO₂被充分吸收;滤渣可循环使用,滤渣的主要成分是Ca(OH)₂(填化学式)。
(3)该工艺需控制NO和NO₂物质的量之比接近1∶1。若n(NO)∶n(NO₂)>1∶1,则会导致排放气体中NO含量升高;若n(NO)∶n(NO₂)<1∶1,则会导致产品Ca(NO₂)₂中Ca(NO₃)₂含量升高。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO₂)₂会发生分解,产物之一是NO,其反应的离子方程式为3NO₂⁻ + 2H⁺ = NO₃⁻ + 2NO↑ + H₂O。
答案:
解析
(1) 若NO与$NO_{2}$反应生成新的氧化物,必然是NO中N的化合价升高被氧化,$NO_{2}$中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于 + 2和 + 4之间,为 + 3价,据此写出反应方程式:$NO + NO_{2}\xlongequal{一定条件}N_{2}O_{3}$。
(2) 气体上升液体下降,这样气液接触充分,使尾气被充分吸收;分析加入的原料及生成物,只有$Ca(OH)_{2}$微溶于水,所以滤渣的主要成分为$Ca(OH)_{2}$。
(3) 当$n(NO)>n(NO_{2})$时,NO过剩;当$n(NO)<n(NO_{2})$时,$NO_{2}$过剩,剩余$NO_{2}$会与$Ca(OH)_{2}$反应生成$Ca(NO_{3})_{2}$。
(4) 依据化合价升降守恒,$NO_{2}^{-}$生成NO时氮元素化合价降低,则$NO_{2}^{-}$中氮元素的化合价也有升高,可能生成$NO_{3}^{-}$或$NO_{2}$,但在水溶液中$NO_{2}$会与水反应生成$NO_{3}^{-}$,所以最终产物为$NO_{3}^{-}$,据此写出离子方程式:$3NO_{2}^{-}+2H^{+}=NO_{3}^{-}+2NO\uparrow+H_{2}O$。 答案
(1)$NO + NO_{2}\xlongequal{一定条件}N_{2}O_{3}$
(2) 使尾气中的NO、$NO_{2}$被充分吸收 $Ca(OH)_{2}$
(3) 排放气体中NO含量升高 产品$Ca(NO_{2})_{2}$中$Ca(NO_{3})_{2}$含量升高
(4)$3NO_{2}^{-}+2H^{+}=NO_{3}^{-}+2NO\uparrow+H_{2}O$
(1) 若NO与$NO_{2}$反应生成新的氧化物,必然是NO中N的化合价升高被氧化,$NO_{2}$中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于 + 2和 + 4之间,为 + 3价,据此写出反应方程式:$NO + NO_{2}\xlongequal{一定条件}N_{2}O_{3}$。
(2) 气体上升液体下降,这样气液接触充分,使尾气被充分吸收;分析加入的原料及生成物,只有$Ca(OH)_{2}$微溶于水,所以滤渣的主要成分为$Ca(OH)_{2}$。
(3) 当$n(NO)>n(NO_{2})$时,NO过剩;当$n(NO)<n(NO_{2})$时,$NO_{2}$过剩,剩余$NO_{2}$会与$Ca(OH)_{2}$反应生成$Ca(NO_{3})_{2}$。
(4) 依据化合价升降守恒,$NO_{2}^{-}$生成NO时氮元素化合价降低,则$NO_{2}^{-}$中氮元素的化合价也有升高,可能生成$NO_{3}^{-}$或$NO_{2}$,但在水溶液中$NO_{2}$会与水反应生成$NO_{3}^{-}$,所以最终产物为$NO_{3}^{-}$,据此写出离子方程式:$3NO_{2}^{-}+2H^{+}=NO_{3}^{-}+2NO\uparrow+H_{2}O$。 答案
(1)$NO + NO_{2}\xlongequal{一定条件}N_{2}O_{3}$
(2) 使尾气中的NO、$NO_{2}$被充分吸收 $Ca(OH)_{2}$
(3) 排放气体中NO含量升高 产品$Ca(NO_{2})_{2}$中$Ca(NO_{3})_{2}$含量升高
(4)$3NO_{2}^{-}+2H^{+}=NO_{3}^{-}+2NO\uparrow+H_{2}O$
查看更多完整答案,请扫码查看


