第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
1.下列有关说法正确的是( )
A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能与铁、铝发生反应
B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性
C.浓硫酸中主要以$H_{2}SO_{4}$分子存在
D.稀硫酸和浓硫酸性质完全相同
A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能与铁、铝发生反应
B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性
C.浓硫酸中主要以$H_{2}SO_{4}$分子存在
D.稀硫酸和浓硫酸性质完全相同
答案:
C [浓硫酸在常温下能够使铁、铝等金属钝化发生了化学反应;浓硫酸中主要以$H_2SO_4$分子形式存在,而稀硫酸中以$H^+$和$SO_4^{2 - }$形式存在,二者性质不同。]
2.下列现象或事实不能用同一原理解释的是( )
A.$SO_{2}$和$CO_{2}$都能使澄清石灰水变浑浊
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硫酸
D.$SO_{2}$和$Na_{2}SO_{3}$溶液都能使氯水褪色
A.$SO_{2}$和$CO_{2}$都能使澄清石灰水变浑浊
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硫酸
D.$SO_{2}$和$Na_{2}SO_{3}$溶液都能使氯水褪色
答案:
C [$SO_2$和$CO_2$都能与$Ca(OH)_2$反应生成难溶或微溶于水的沉淀,A不选;硫化钠及亚硫酸钠都具有还原性,易被空气中的氧气氧化而变质,B不选;常温下铁遇浓硫酸,发生钝化;铂的活泼性较弱,不与浓硫酸反应,不能用同一原理解释,C可选;$SO_2$和$Na_2SO_3$都具有还原性,都能与氯水发生氧化还原反应使氯水褪色,D不选。]
3.某溶液中滴入$BaCl_{2}$溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.可能有$SO_{4}^{2 - }$或$Ag^{ + }$
B.一定有$SO_{4}^{2 - }$
C.一定无$Ag^{ + }$
D.可能有$CO_{3}^{2 - }$
A.可能有$SO_{4}^{2 - }$或$Ag^{ + }$
B.一定有$SO_{4}^{2 - }$
C.一定无$Ag^{ + }$
D.可能有$CO_{3}^{2 - }$
答案:
A [某溶液中滴入$BaCl_2$溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则沉淀为硫酸钡或氯化银,故原溶液中可能含有$SO_4^{2 - }$或$Ag^+$,答案为A。]
4.如图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
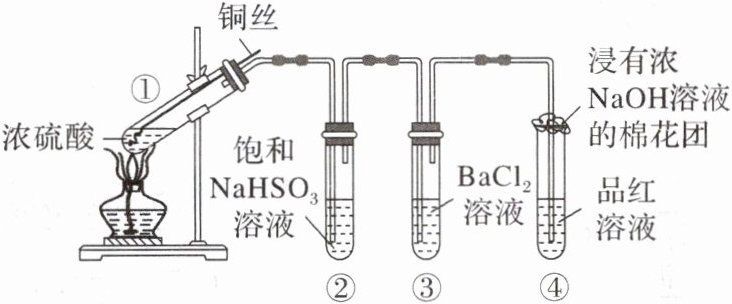
(1)①中反应的化学方程式是______。
(2)②中饱和$NaHSO_{3}$溶液的作用是除去①中$SO_{2}$气流带出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。若要立即终止铜与硫酸的反应,恰当的方法是______。
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
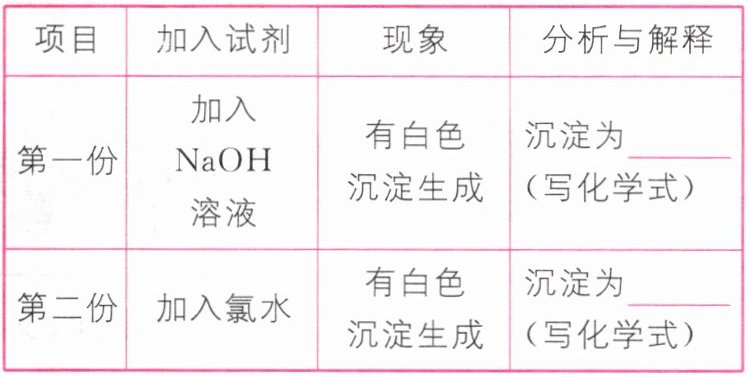
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
(4)④中棉花团的作用是______(用离子方程式表示)。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是______。|

(1)①中反应的化学方程式是______。
(2)②中饱和$NaHSO_{3}$溶液的作用是除去①中$SO_{2}$气流带出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。若要立即终止铜与硫酸的反应,恰当的方法是______。
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:

(4)④中棉花团的作用是______(用离子方程式表示)。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是______。|
答案:
解析 (1)在①中$Cu$与浓硫酸混合加热,发生氧化还原反应产生硫酸铜、二氧化硫和水,反应的化学方程式是$Cu + 2H_2SO_4(浓) \stackrel{\triangle}{=} CuSO_4 + SO_2↑ + 2H_2O$;(2)$SO_2$气流带出的硫酸能够与氯化钡反应生成硫酸钡沉淀,对二氧化硫的性质检验造成干扰,可以用饱和亚硫酸氢钠溶液除去挥发出的硫酸,要立即终止铜与硫酸的反应,可以上移铜丝,使其脱离硫酸;撤去酒精灯,容易发生倒吸;拔去橡胶塞倒出硫酸,操作复杂,故合理选项是a;(3)二氧化硫为酸性氧化物,与氢氧化钠反应生成亚硫酸钠溶液,亚硫酸钠与氯化钡反应生成亚硫酸钡沉淀,其化学式是$BaSO_3$;二氧化硫具有还原性,能够被氯水氧化生成硫酸,硫酸与氯化钡反应生成$BaSO_4$白色沉淀,故该白色沉淀化学式为$BaSO_4$;(4)棉花团浸有$NaOH$溶液,可吸收酸性氧化物二氧化硫,防止其污染空气,该反应的离子方程式为$SO_2 + 2OH^- = SO_3^{2 - } + H_2O$;(5)蓝色溶液中含有硫酸和硫酸铜,向其中加入氢氧化钠溶液后,氢氧化钠先与硫酸发生中和反应,然后再与硫酸铜反应,因此看到现象为开始没有明显现象,后来有蓝色沉淀生成。
答案 (1)$Cu + 2H_2SO_4(浓) \stackrel{\triangle}{=} CuSO_4 + SO_2↑ + 2H_2O$ (2)a (3)$BaSO_3$ $BaSO_4$ (4)$SO_2 + 2OH^- = SO_3^{2 - } + H_2O$ (5)开始无明显现象,后来有蓝色沉淀生成
查看更多完整答案,请扫码查看


