第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
微训练
1.关于单质硫的叙述有:①通常状况下为黄色粉末;②不溶于水、微溶于酒精、易溶于二硫化碳;③氧化性比氯气弱;④只能被还原不能被氧化;⑤医药上用来做硫黄软膏治疗某些皮肤病。其中正确的是( )
A.①②③⑤
B.②③⑤
C.②④⑤
D.③⑤
1.关于单质硫的叙述有:①通常状况下为黄色粉末;②不溶于水、微溶于酒精、易溶于二硫化碳;③氧化性比氯气弱;④只能被还原不能被氧化;⑤医药上用来做硫黄软膏治疗某些皮肤病。其中正确的是( )
A.①②③⑤
B.②③⑤
C.②④⑤
D.③⑤
答案:
A [①单质硫在常温下是一种淡黄色粉末状的固体,故①正确;②单质硫不溶于水,微溶于酒精,易溶于CS₂,故②正确;③S元素的非金属性比Cl元素弱,因此单质硫的氧化性比氯气弱,故③正确;④在单质硫中,S元素的化合价为0价,处于S元素的最高+6价和最低-2价之间,因此S单质既有氧化性又有还原性,既能被氧化又能被还原,故④错误;⑤单质硫能杀死病菌,医药上用来制硫黄软膏,治疗某些皮肤病,故⑤正确;正确的是①②③⑤。]
2.食品添加剂是指为改善食品的色、香、味,以及对食品进行防腐和加工而加入食品中的化学合成或天然物质。下列关于SO₂的说法正确的是( )
A.SO₂具有还原性,不能用浓硫酸干燥
B.SO₂是一种无色无味的有毒气体
C.SO₂可以使酸性KMnO₄溶液褪色,体现了它的漂白性
D.SO₂具有还原性,少量的SO₂可防止葡萄酒氧化变质
A.SO₂具有还原性,不能用浓硫酸干燥
B.SO₂是一种无色无味的有毒气体
C.SO₂可以使酸性KMnO₄溶液褪色,体现了它的漂白性
D.SO₂具有还原性,少量的SO₂可防止葡萄酒氧化变质
答案:
D [A项,SO₂中硫元素显+4价,H₂SO₄中硫元素显+6价,同种元素相邻价态之间不发生氧化还原反应,故SO₂可以用浓硫酸干燥;B项,SO₂是一种无色、有刺激性气味的有毒气体;C项,SO₂能与酸性高锰酸钾溶液发生氧化还原反应使酸性高锰酸钾溶液褪色,体现了SO₂的还原性,而不是漂白性;D项,葡萄酒中加入少量SO₂的作用是防止葡萄酒在陈酿和贮藏的过程中被氧化,抑制葡萄汁中微生物的活动。]
3.可逆反应是在相同条件下能同时向正、逆两个方向进行的反应。下列反应不属于可逆反应的是___。
①SO₂ + H₂O⇌H₂SO₃
②Cl₂ + H₂O⇌HCl + HClO
③2H₂ + O₂$\frac{点燃}{通电}$2H₂O
④2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
⑤6CO₂ + 6H₂O$\frac{光合作用}{氧化作用}$6O₂ + C₆H₁₂O₆
①SO₂ + H₂O⇌H₂SO₃
②Cl₂ + H₂O⇌HCl + HClO
③2H₂ + O₂$\frac{点燃}{通电}$2H₂O
④2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
⑤6CO₂ + 6H₂O$\frac{光合作用}{氧化作用}$6O₂ + C₆H₁₂O₆
答案:
③④⑤
1.中医用药讲究十八反和十九畏,其中有“硫黄原是火中精,朴硝一见便相争”的说法,硫黄即硫单质。下列关于硫的说法中正确的是( )
A.硫是一种淡黄色的能溶于水的固体
B.试管内壁上的硫黄可用二硫化碳清洗
C.过量的硫与铁反应生成Fe₂S₃,表现了硫单质的氧化性
D.硫在空气中燃烧生成二氧化硫,硫在过量氧气中燃烧生成三氧化硫
A.硫是一种淡黄色的能溶于水的固体
B.试管内壁上的硫黄可用二硫化碳清洗
C.过量的硫与铁反应生成Fe₂S₃,表现了硫单质的氧化性
D.硫在空气中燃烧生成二氧化硫,硫在过量氧气中燃烧生成三氧化硫
答案:
B
2.下列化合物中,不能由组成该化合物的两种元素的单质直接化合而成的是( )
A.CuS
B.SO₂
C.FeS
D.Na₂S
A.CuS
B.SO₂
C.FeS
D.Na₂S
答案:
A
3.有如下实验现象:①澄清石灰水变浑浊;②湿润的红色石蕊试纸变蓝;③使品红溶液褪色;④通入足量的氢氧化钠溶液中,再滴加氯化钡溶液时有白色沉淀生成,该沉淀溶于稀盐酸;⑤通入溴水中能使溴水褪色,再滴加氯化钡溶液有白色沉淀产生。其中能证明含有SO₂的是( )
A.①②③④⑤
B.都不能证明
C.③④⑤
D.⑤
A.①②③④⑤
B.都不能证明
C.③④⑤
D.⑤
答案:
D
4.Cl₂和SO₂都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl₂、SO₂混合后再通入品红与BaCl₂的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①②
B.①③
C.②③
D.②④
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①②
B.①③
C.②③
D.②④
答案:
C [等物质的量的Cl₂和SO₂混合通入品红与BaCl₂的混合溶液,涉及的化学反应为Cl₂ + SO₂ + 2H₂O = H₂SO₄ + 2HCl、BaCl₂ + H₂SO₄ = BaSO₄↓ + 2HCl,相应的现象是溶液不会褪色,出现白色沉淀。]
5.将SO₂气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
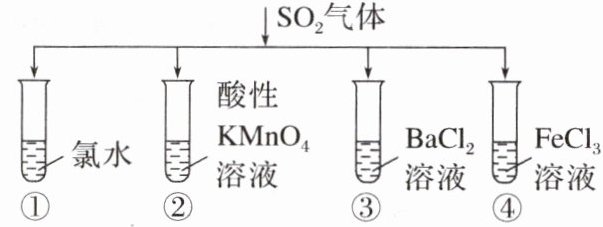
A.试管①有淡黄色沉淀生成,说明SO₂有氧化性
B.试管②中溶液褪色,说明SO₂有漂白性
C.试管③中能产生白色沉淀,说明SO₂有酸性
D.试管④中溶液颜色变浅,说明SO₂有还原性

A.试管①有淡黄色沉淀生成,说明SO₂有氧化性
B.试管②中溶液褪色,说明SO₂有漂白性
C.试管③中能产生白色沉淀,说明SO₂有酸性
D.试管④中溶液颜色变浅,说明SO₂有还原性
答案:
D [A项,SO₂与氯水发生氧化还原反应不产生淡黄色沉淀;B项,试管②中溶液褪色,因为SO₂与酸性KMnO₄溶液发生氧化还原反应,表现了SO₂的还原性;C项,SO₂与BaCl₂溶液不反应,试管③中不能产生白色沉淀;D项,SO₂与氯化铁溶液反应,二氧化硫被氧化生成硫酸,铁离子被还原生成亚铁离子,溶液颜色变浅,说明SO₂有还原性。]
6.下列离子方程式正确的是( )
A.向NaOH溶液中通入少量SO₂:SO₂ + OH⁻ = HSO₃⁻
B.向氯水中通入少量SO₂:Cl₂ + SO₂ + 2H₂O = 4H⁺ + 2Cl⁻ + SO₄²⁻
C.将SO₂通入NaClO溶液中:H₂O + SO₂ + 2ClO⁻ = 2HClO + SO₃²⁻
D.将SO₂通入BaCl₂溶液中:SO₂ + H₂O + Ba²⁺ = BaSO₃↓ + 2H⁺
A.向NaOH溶液中通入少量SO₂:SO₂ + OH⁻ = HSO₃⁻
B.向氯水中通入少量SO₂:Cl₂ + SO₂ + 2H₂O = 4H⁺ + 2Cl⁻ + SO₄²⁻
C.将SO₂通入NaClO溶液中:H₂O + SO₂ + 2ClO⁻ = 2HClO + SO₃²⁻
D.将SO₂通入BaCl₂溶液中:SO₂ + H₂O + Ba²⁺ = BaSO₃↓ + 2H⁺
答案:
B [SO₂与过量NaOH溶液反应生成Na₂SO₃和水,反应离子方程式为SO₂ + 2OH⁻ = SO₃²⁻ + H₂O,A项错误;B项正确;将SO₂通入NaClO溶液中,反应的离子方程式为:SO₂ + ClO⁻ + H₂O = SO₄²⁻ + Cl⁻ + 2H⁺,C项错误;H₂SO₃酸性比盐酸弱,故SO₂通入BaCl₂(或CaCl₂)溶液中不反应,D项错误。]
7.下列各组两个反应互为可逆反应的是( )
①H₂ + Cl₂$\frac{点燃}{}$2HCl与2HCl$\frac{电解}{}$H₂↑ + Cl₂↑
②H₂SO₄(浓) + 2HBr = 2H₂O + Br₂ + SO₂↑与Br₂ + SO₂ + 2H₂O = 2HBr + H₂SO₄
③2NO₂ = N₂O₄与N₂O₄ = 2NO₂
④2SO₂ + O₂$\frac{催化剂}{\triangle}$2SO₃与2SO₃$\frac{催化剂}{\triangle}$2SO₂ + O₂
A.①②
B.②③
C.③④
D.②④
①H₂ + Cl₂$\frac{点燃}{}$2HCl与2HCl$\frac{电解}{}$H₂↑ + Cl₂↑
②H₂SO₄(浓) + 2HBr = 2H₂O + Br₂ + SO₂↑与Br₂ + SO₂ + 2H₂O = 2HBr + H₂SO₄
③2NO₂ = N₂O₄与N₂O₄ = 2NO₂
④2SO₂ + O₂$\frac{催化剂}{\triangle}$2SO₃与2SO₃$\frac{催化剂}{\triangle}$2SO₂ + O₂
A.①②
B.②③
C.③④
D.②④
答案:
C [可逆反应要求的是相同条件,①呈现的反应条件不同,②两个反应中硫酸的浓度不同,③④条件相同,故③④互为可逆反应。]
查看更多完整答案,请扫码查看


