第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
1.请从化学反应快慢的角度解释人们为什么使用电冰箱保存食物。
答案:
食物腐败是因为发生了化学反应,在其他条件相同时,温度越低,化学反应速率越小,人们用电冰箱把食物放置在低温下保存,以减缓食物的腐败。
2.工业生产硫酸时,要先将黄铁矿矿石(主要成分为$FeS_{2}$)粉碎后,再投入沸腾炉,为什么?
答案:
将铁矿石粉碎,是为了增大与空气的接触面积,增大反应速率。
3.铁粉与一定浓度的稀盐酸反应时,增加铁粉的用量能否增大化学反应速率?
答案:
不能。对于固态或纯液态物质,浓度可视为常数,改变其用量,浓度不发生改变,不影响化学反应速率。
1.下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能增大化学反应速率
B.使用催化剂,使反应的活化能降低,反应速率增大,但不改变反应历程
C.反应物浓度是决定化学反应速率的主要因素
D.升高温度,一般能增大化学反应速率
A.增大压强一定能增大化学反应速率
B.使用催化剂,使反应的活化能降低,反应速率增大,但不改变反应历程
C.反应物浓度是决定化学反应速率的主要因素
D.升高温度,一般能增大化学反应速率
答案:
D [A项,压强对反应速率的影响只适用于有气体参与的反应,即改变压强,反应速率不一定改变,A项不正确。B项,催化剂能改变反应的历程,B项不正确。C项,参加反应的物质的性质是决定化学反应速率的主要因素,C项不正确。D项,升高温度,一般能加快化学反应速率,D项正确。]
2.已知$4A + 5B = 2C + 6D$,则关于反应速率正确的关系是( )
A.$4v(A)=5v(B)$
B.$5v(B)=6v(D)$
C.$2v(A)=3v(D)$
D.$2v(B)=5v(C)$
A.$4v(A)=5v(B)$
B.$5v(B)=6v(D)$
C.$2v(A)=3v(D)$
D.$2v(B)=5v(C)$
答案:
D [A项,$4v(A)=5v(B)$,则$\frac{v(A)}{v(B)}=\frac{5}{4}$,速率之比不等于化学计量数之比;B项,$5v(B)=6v(D)$,则$\frac{v(B)}{v(D)}=\frac{6}{5}$,速率之比不等于化学计量数之比;C项,$2v(A)=3v(D)$,则$\frac{v(A)}{v(D)}=\frac{3}{2}$,速率之比不等于化学计量数之比;D项,$2v(B)=5v(C)$,则$\frac{v(B)}{v(C)}=\frac{5}{2}$,速率之比等于化学计量数之比。]
3.反应$4A(s)+3B(g)\rightleftharpoons 2C(g)+D(g)$经2 min B的浓度减少$0.6mol\cdot L^{-1}$。下列有关说法正确的有( )
①用A表示的反应速率是$0.4mol\cdot L^{-1}\cdot min^{-1}$
②在2 min末时,反应物B的反应速率是$0.3mol\cdot L^{-1}\cdot min^{-1}$
③在这2 min内用C表示的平均速率为$0.2mol\cdot L^{-1}\cdot min^{-1}$
④在2 min时,B、C、D的浓度比一定为3:2:1
⑤若D的起始浓度为$0.1mol\cdot L^{-1}$,则2 min末时D的浓度为$0.3mol\cdot L^{-1}$
A.③⑤
B.④⑤
C.①③⑤
D.①②③
①用A表示的反应速率是$0.4mol\cdot L^{-1}\cdot min^{-1}$
②在2 min末时,反应物B的反应速率是$0.3mol\cdot L^{-1}\cdot min^{-1}$
③在这2 min内用C表示的平均速率为$0.2mol\cdot L^{-1}\cdot min^{-1}$
④在2 min时,B、C、D的浓度比一定为3:2:1
⑤若D的起始浓度为$0.1mol\cdot L^{-1}$,则2 min末时D的浓度为$0.3mol\cdot L^{-1}$
A.③⑤
B.④⑤
C.①③⑤
D.①②③
答案:
A [①A为固体,因为固体和液体的浓度认为是定值,不发生变化,①错误;②2 min末的反应速率为瞬时速率,用B表示的速率$0.3mol/(L\cdot min)$是2 min内的平均速率,②错误;③根据化学反应速率之比等于化学计量系数之比,在这2 min内用C表示的平均速率为B的平均速率的$\frac{2}{3}$,即$0.2mol\cdot L^{-1}\cdot min^{-1}$,③正确;④因为起始浓度未知,因此在2 min时,B、C、D的浓度比不一定为3∶2∶1,④错误;⑤根据浓度的变化量之比等于化学计量系数之比,2 min内D的浓度增加了$0.2mol\cdot L^{-1}$,若D的起始浓度为$0.1mol\cdot L^{-1}$,则2 min末时D的浓度为$0.3mol\cdot L^{-1}$,⑤正确。]
4.化学反应的快慢对人类生产生活有重要的意义。
Ⅰ.将影响反应速率的条件填在空格处。

Ⅱ.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(2)上述实验中发生反应的化学方程式有____________________。
(3)硫酸铜溶液可以加快氢气生成速率的原因是____________________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有____________________(写出两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
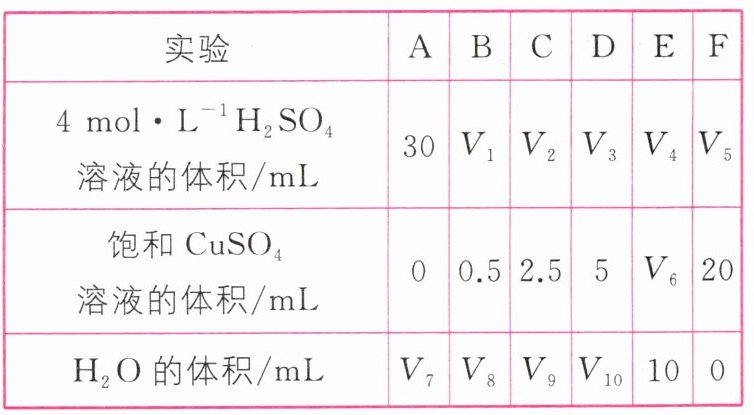
①请完成此实验设计,其中$V_{1}=$__________,$V_{6}=$__________,$V_{9}=$__________。
②该同学最后得出的结论为当加入少量$CuSO_{4}$溶液时,生成氢气的速率会大大提高,但当加入的$CuSO_{4}$溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:____________________。
Ⅰ.将影响反应速率的条件填在空格处。

Ⅱ.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(2)上述实验中发生反应的化学方程式有____________________。
(3)硫酸铜溶液可以加快氢气生成速率的原因是____________________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有____________________(写出两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

①请完成此实验设计,其中$V_{1}=$__________,$V_{6}=$__________,$V_{9}=$__________。
②该同学最后得出的结论为当加入少量$CuSO_{4}$溶液时,生成氢气的速率会大大提高,但当加入的$CuSO_{4}$溶液超过一定量时,生成氢气的速率反而会下降。请分析生成氢气速率下降的主要原因:____________________。
答案:
答案 Ⅰ.(1)温度 催化剂
Ⅱ.(2)$CuSO_{4}+Zn=ZnSO_{4}+Cu$、$Zn+H_{2}SO_{4}=ZnSO_{4}+H_{2}\uparrow$
(3)$CuSO_{4}$与$Zn$反应产生的$Cu$和$Zn$以及稀硫酸形成原电池,加快了氢气产生的速率
(4)升高反应温度、适当增大稀硫酸的浓度、增加锌的比表面积等(答两种即可)
(5)①30 10 17.5
②当加入大量的$CuSO_{4}$溶液后,生成的单质$Cu$会沉积在$Zn$的表面,减小了$Zn$与稀$H_{2}SO_{4}$的接触面积
查看更多完整答案,请扫码查看


