第24页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
8. 无色的混合气体甲,可能含NO、CO₂、NO₂、N₂中的几种,将一定量的甲气体经过如图实验装置,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(B)

A. NO₂、N₂
B. NO、CO₂
C. NO₂、CO₂
D. NO、CO₂、N₂

A. NO₂、N₂
B. NO、CO₂
C. NO₂、CO₂
D. NO、CO₂、N₂
答案:
B [混合气体无色,气体中不含$NO_{2}$,气体通过$Na_{2}O_{2}$后显红棕色,说明原混合气体中含有NO,且有与$Na_{2}O_{2}$反应生成$O_{2}$的气体$CO_{2}$,通入水中,溶液呈酸性,且几乎无气体剩余,说明原混合气体中不含$N_{2}$。]
9. 将10 mL NO和NO₂的混合气体通入装满水的倒立在水槽中的量筒中,充分反应后,最后剩余4 mL气体(已知一氧化氮与水不反应,二氧化氮与水反应:3NO₂ + H₂O = 2HNO₃ + NO),则原混合气体中NO的体积为(A)
A. 1 mL
B. 3 mL
C. 5 mL
D. 7 mL
A. 1 mL
B. 3 mL
C. 5 mL
D. 7 mL
答案:
A [将NO、$NO_{2}$混合气体通入装满水的倒立在水槽中的量筒中,NO和水不反应,$NO_{2}$气体发生反应:$3NO_{2}+H_{2}O = 2HNO_{3}+NO$,根据方程式可知:每消耗3体积$NO_{2}$,就产生1体积NO,反应后气体体积减小2体积。现在气体体积减小了10 mL - 4 mL = 6 mL,则混合气体中$NO_{2}$的体积$V(NO_{2})=\frac{3}{2}\times6 mL = 9 mL$,则混合气体中含有NO的体积$V(NO)=10 mL - 9 mL = 1 mL$,故合理选项是A。]
10. NH₃可消除NO的污染,反应方程式为6NO + 4NH₃$\stackrel{催化剂}{=\!=\!=}$5N₂ + 6H₂O。现有1 mol NO与NH₃的混合物充分反应,若还原产物比氧化产物多1.4 g,则下列判断中正确的是(D)
A. 原混合物中NO与NH₃的物质的量之比一定为3∶7
B. 有0.6 mol NH₃被氧化
C. 生成还原产物2.8 g
D. 原混合气体中含氨气为0.2 mol或0.7 mol
A. 原混合物中NO与NH₃的物质的量之比一定为3∶7
B. 有0.6 mol NH₃被氧化
C. 生成还原产物2.8 g
D. 原混合气体中含氨气为0.2 mol或0.7 mol
答案:
D [由方程式$6NO + 4NH_{3}\xlongequal{催化剂}5N_{2}+6H_{2}O$可知,6 mol NO被还原得到3 mol还原产物$N_{2}$,4 mol $NH_{3}$被氧化得到2 mol氧化产物$N_{2}$,相差1 mol $N_{2}$,若还原产物比氧化产物多1.4 g,即0.05 mol $N_{2}$,则相当于0.3 mol NO和0.2 mol $NH_{3}$反应。由题意可知NO和$NH_{3}$的总物质的量为1 mol,则其中一种过量,所以有两种情况:0.3 mol NO和0.7 mol $NH_{3}$或0.2 mol $NH_{3}$和0.8 mol NO,故原混合物中NO与$NH_{3}$的物质的量之比为3∶7或4∶1,A错误;由以上分析可知,有0.2 mol $NH_{3}$被氧化,B错误;还原产物的物质的量为0.15 mol,即4.2 g,C错误;原混合气体中含氨气为0.2 mol或0.7 mol,D正确。]
11. 有一倒置于水槽且装满水的容器,向其中依次通入一定体积的NO₂、NO和O₂,充分反应后,若容器中仍充满溶液,则通入的NO₂、NO和O₂的体积比可能是(D)
A. 1∶1∶2
B. 4∶3∶2
C. 4∶16∶13
D. 4∶3∶4
A. 1∶1∶2
B. 4∶3∶2
C. 4∶16∶13
D. 4∶3∶4
答案:
C
12. 下列气体去除杂质的方法中,不能实现目的的是(A)
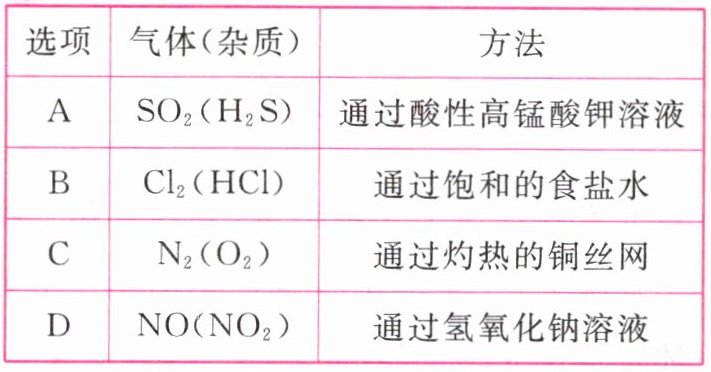

答案:
A [二氧化硫和硫化氢都具有还原性,都能与酸性高锰酸钾溶液发生氧化还原反应,不能用酸性高锰酸钾溶液除去二氧化硫中的硫化氢气体,A项符合题意;HCl极易溶于水,氯气在饱和食盐水中溶解度很小,可用饱和食盐水除去氯气中的氯化氢气体,B项不符合题意;铜与氧气在加热条件下反应生成氧化铜,铜与氮气不反应,故可用灼热的铜丝网除去氮气中的氧气,C项不符合题意;虽然$NO_{2}$和NO通入NaOH溶液中会发生反应$NO + NO_{2}+2NaOH = 2NaNO_{2}+H_{2}O$,但一般情况下含有杂质的量较少,用NaOH溶液除去NO中的$NO_{2}$,会损失一部分NO,但仍然能达到实验目的,D项不符合题意。]
13. 以下是氮循环的一部分:
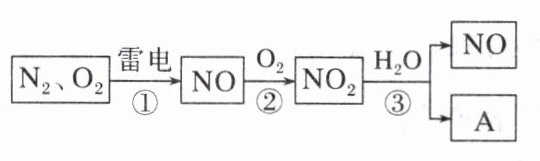
(1)NO₂的颜色是红棕色。
(2)反应①的化学方程式是N₂ + O₂$\stackrel{放电}{=\!=\!=}$2NO。
(3)NO₂易溶于水,并和水发生化学反应。该反应方程式为3NO₂ + H₂O = 2HNO₃ + NO,其中氧化剂是NO₂。
(4)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO + 2CO$\stackrel{催化剂}{=\!=\!=}$2CO₂ + N₂,当生成2 mol N₂时,被还原的NO 4 mol。

(1)NO₂的颜色是红棕色。
(2)反应①的化学方程式是N₂ + O₂$\stackrel{放电}{=\!=\!=}$2NO。
(3)NO₂易溶于水,并和水发生化学反应。该反应方程式为3NO₂ + H₂O = 2HNO₃ + NO,其中氧化剂是NO₂。
(4)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO + 2CO$\stackrel{催化剂}{=\!=\!=}$2CO₂ + N₂,当生成2 mol N₂时,被还原的NO 4 mol。
答案:
解析 空气中的$N_{2}$在放电条件下与$O_{2}$直接化合生成无色且不溶于水的NO气体,$N_{2}+O_{2}\xlongequal{放电}2NO$,NO常温下就易与空气中的$O_{2}$反应生成红棕色的$NO_{2}$气体,$2NO + O_{2}=2NO_{2}$,$NO_{2}$气体有毒,易与水反应生成$HNO_{3}$(A)和NO,$3NO_{2}+H_{2}O = 2HNO_{3}+NO$。
(1)$NO_{2}$是红棕色气体;
(2) 根据分析,反应①的化学方程式是$N_{2}+O_{2}\xlongequal{放电}2NO$;
(3) 根据分析,$NO_{2}$与水反应生成NO和$HNO_{3}$,方程式为$3NO_{2}+H_{2}O = 2HNO_{3}+NO$;$NO_{2}$中N的化合价由 + 4价歧化为 + 5价和 + 2价,因此$NO_{2}$既是氧化剂又是还原剂;
(4) NO与CO反应生成$CO_{2}$和$N_{2}$,反应为$2NO + 2CO\xlongequal{催化剂}2CO_{2}+N_{2}$,N的化合价由 + 2价降低为0价,化合价降低被还原,生成2 mol氮气,被还原的NO为4 mol。 答案
(1) 红棕色
(2)$N_{2}+O_{2}\xlongequal{放电}2NO$
(3)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ $NO_{2}$
(4) 4
(1)$NO_{2}$是红棕色气体;
(2) 根据分析,反应①的化学方程式是$N_{2}+O_{2}\xlongequal{放电}2NO$;
(3) 根据分析,$NO_{2}$与水反应生成NO和$HNO_{3}$,方程式为$3NO_{2}+H_{2}O = 2HNO_{3}+NO$;$NO_{2}$中N的化合价由 + 4价歧化为 + 5价和 + 2价,因此$NO_{2}$既是氧化剂又是还原剂;
(4) NO与CO反应生成$CO_{2}$和$N_{2}$,反应为$2NO + 2CO\xlongequal{催化剂}2CO_{2}+N_{2}$,N的化合价由 + 2价降低为0价,化合价降低被还原,生成2 mol氮气,被还原的NO为4 mol。 答案
(1) 红棕色
(2)$N_{2}+O_{2}\xlongequal{放电}2NO$
(3)$3NO_{2}+H_{2}O = 2HNO_{3}+NO$ $NO_{2}$
(4) 4
14. 汽车尾气净化装置“催化转化器”是防止尾气(含一氧化碳、氮氧化物等气体)污染的有效方法,能使尾气中的一氧化碳和氮氧化物发生反应生成可参与大气生态循环的无毒气体。
(1)汽车尾气中易造成光化学烟雾的物质是a(a.氮氧化物 b.二氧化碳 c.一氧化碳)。
(2)安装汽车尾气催化转化器可将CO和NO₂转化为两种无污染的气体,反应的化学方程式为4CO + 2NO₂$\stackrel{催化剂}{=\!=\!=}$4CO₂ + N₂。
(3)下列措施中有利于控制城市空气污染的是ac(a.推广电动汽车 b.加快煤炭开采和使用 c.开发和使用氢能)。
(4)可利用CH₄等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH₄与NO反应的化学方程式:4NO + CH₄$\stackrel{催化剂}{=\!=\!=}$2N₂ + CO₂ + 2H₂O。
(5)采用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO₂ + 2NaOH = NaNO₂ + NaNO₃ + H₂O。若反应时消耗了10 L 0.1 mol·L⁻¹的NaOH溶液,则反应中转移电子的物质的量为0.5 mol。
(1)汽车尾气中易造成光化学烟雾的物质是a(a.氮氧化物 b.二氧化碳 c.一氧化碳)。
(2)安装汽车尾气催化转化器可将CO和NO₂转化为两种无污染的气体,反应的化学方程式为4CO + 2NO₂$\stackrel{催化剂}{=\!=\!=}$4CO₂ + N₂。
(3)下列措施中有利于控制城市空气污染的是ac(a.推广电动汽车 b.加快煤炭开采和使用 c.开发和使用氢能)。
(4)可利用CH₄等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH₄与NO反应的化学方程式:4NO + CH₄$\stackrel{催化剂}{=\!=\!=}$2N₂ + CO₂ + 2H₂O。
(5)采用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO₂ + 2NaOH = NaNO₂ + NaNO₃ + H₂O。若反应时消耗了10 L 0.1 mol·L⁻¹的NaOH溶液,则反应中转移电子的物质的量为0.5 mol。
答案:
答案
(1) a
(2)$2NO_{2}+4CO\xlongequal{催化剂}4CO_{2}+N_{2}$
(3) ac
(4)$CH_{4}+4NO\xlongequal{一定条件}CO_{2}+2H_{2}O+2N_{2}$
(5) 0.5
(1) a
(2)$2NO_{2}+4CO\xlongequal{催化剂}4CO_{2}+N_{2}$
(3) ac
(4)$CH_{4}+4NO\xlongequal{一定条件}CO_{2}+2H_{2}O+2N_{2}$
(5) 0.5
查看更多完整答案,请扫码查看


