第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
12.甲、乙两位同学各设计一个实验来检验SO₄²⁻,且都认为自己的试样中含有SO₄²⁻,其方案如下:
甲:试样X(无色溶液)$\xrightarrow{加BaCl_{2}溶液}$白色沉淀$\xrightarrow{加足量稀盐酸}$沉淀不溶解
乙:试样Y(无色溶液)$\xrightarrow{加Ba(NO_{3})_{2}溶液}$白色沉淀$\xrightarrow{加足量稀硝酸}$沉淀不溶解
回答以下问题:
(1)你认为甲、乙两位同学所设计的实验方案是否严谨,甲 、乙 (填“严谨”或“不严谨”),并说明理由: 。
(2)如果你认为甲、乙方案均不严谨,请你设计一个合理的实验方案: 。
甲:试样X(无色溶液)$\xrightarrow{加BaCl_{2}溶液}$白色沉淀$\xrightarrow{加足量稀盐酸}$沉淀不溶解
乙:试样Y(无色溶液)$\xrightarrow{加Ba(NO_{3})_{2}溶液}$白色沉淀$\xrightarrow{加足量稀硝酸}$沉淀不溶解
回答以下问题:
(1)你认为甲、乙两位同学所设计的实验方案是否严谨,甲 、乙 (填“严谨”或“不严谨”),并说明理由: 。
(2)如果你认为甲、乙方案均不严谨,请你设计一个合理的实验方案: 。
答案:
(1) 不严谨 不严谨 甲没有排除Ag⁺的干扰,乙没有排除SO₃²⁻的干扰
(2) 向试样中先加过量的盐酸酸化,无明显现象,然后再加入BaCl₂溶液,若有白色沉淀产生,则说明含有SO₄²⁻,若无沉淀生成,则说明不含SO₄²⁻
(1) 不严谨 不严谨 甲没有排除Ag⁺的干扰,乙没有排除SO₃²⁻的干扰
(2) 向试样中先加过量的盐酸酸化,无明显现象,然后再加入BaCl₂溶液,若有白色沉淀产生,则说明含有SO₄²⁻,若无沉淀生成,则说明不含SO₄²⁻
13.硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
浓H₂SO₄$\xrightarrow[①]{Cu}$SO₂$\xrightarrow[②]{NaOH溶液}$Na₂SO₃$\xrightarrow[③]{S}$Na₂S₂O₃$\xrightarrow[④]{稀H_{2}SO_{4}}$S
下列判断不正确的是 ( )
A.反应①中氧化剂与还原剂物质的量之比为1:1
B.反应②表明SO₂具有酸性氧化物的性质
C.反应③属于四大基本反应类型中的化合反应
D.反应④中稀H₂SO₄作氧化剂
浓H₂SO₄$\xrightarrow[①]{Cu}$SO₂$\xrightarrow[②]{NaOH溶液}$Na₂SO₃$\xrightarrow[③]{S}$Na₂S₂O₃$\xrightarrow[④]{稀H_{2}SO_{4}}$S
下列判断不正确的是 ( )
A.反应①中氧化剂与还原剂物质的量之比为1:1
B.反应②表明SO₂具有酸性氧化物的性质
C.反应③属于四大基本反应类型中的化合反应
D.反应④中稀H₂SO₄作氧化剂
答案:
D [反应①为浓硫酸氧化铜单质的反应,浓硫酸作氧化剂被还原成SO₂,化合价由 + 6价降低到 + 4价,Cu作还原剂被氧化成Cu²⁺,化合价由0升高到 + 2价,所以氧化剂与还原剂物质的量之比为1 : 1,故A正确;二氧化硫与NaOH反应生成盐和水,表明二氧化硫为酸性氧化物,故B正确;反应③为Na₂SO₃ + S$\xlongequal{}$Na₂S₂O₃,生成物只有一种,属于四大基本反应类型中的化合反应,故C正确;反应④的化学方程式:Na₂S₂O₃ + H₂SO₄$\xlongequal{}$Na₂SO₄ + S↓ + SO₂↑ + H₂O,稀硫酸既不是氧化剂也不是还原剂,故D错误。]
14.已知X为某种常见酸的浓溶液,能使蔗糖变黑。A、B、C、D、X五种物质的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是 ( )
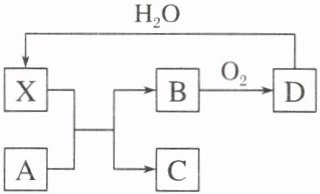
A.X使胆矾晶体变白的现象体现了X的吸水性
B.若A为铜,则A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最终没有白色沉淀产生
D.1 mol B与足量氧气混合在一定条件下反应生成D,转移电子数小于2Nₐ

A.X使胆矾晶体变白的现象体现了X的吸水性
B.若A为铜,则A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最终没有白色沉淀产生
D.1 mol B与足量氧气混合在一定条件下反应生成D,转移电子数小于2Nₐ
答案:
B [X为某种常见酸的浓溶液,能使蔗糖变黑,则X为H₂SO₄,D与水反应生成硫酸,则D为SO₃,B与氧气反应生成SO₃,则B为SO₂;A与浓硫酸反应可以生成SO₂,则A应是一种具有还原性的物质或Na₂SO₃等。A项,浓硫酸具有吸水性,可以吸收胆矾晶体中的水分子,从而使其变白;B项,Cu在常温下不与浓硫酸反应;C项,碳单质与浓硫酸在加热条件下可以反应生成SO₂、CO₂和H₂O,B为SO₂、C为CO₂,若将CO₂通入少量的澄清石灰水中,最终生成可溶于水的碳酸氢钙,没有白色沉淀;D项,O₂与SO₂的反应为可逆反应,1 mol SO₂无法完全反应,转移电子数小于2Nₐ。]
15.已知X、Y都为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。
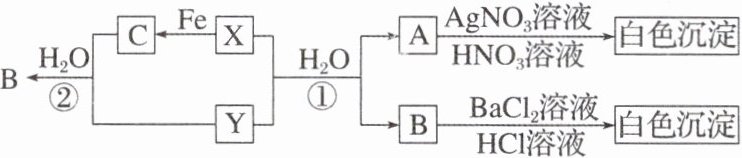
回答下列问题:
(1)写出下列各物质的化学式:
X 、Y 、A 、B 、C 。
(2)反应①的方程式方程式为 。
反应②的方程式方程式为 。

回答下列问题:
(1)写出下列各物质的化学式:
X 、Y 、A 、B 、C 。
(2)反应①的方程式方程式为 。
反应②的方程式方程式为 。
答案:
(1) Cl₂ SO₂ HCl H₂SO₄ FeCl₃
(2) Cl₂ + SO₂ + 2H₂O$\xlongequal{}$2HCl + H₂SO₄ 2Fe³⁺ + SO₂ + 2H₂O$\xlongequal{}$2Fe²⁺ + SO₄²⁻ + 4H⁺
(1) Cl₂ SO₂ HCl H₂SO₄ FeCl₃
(2) Cl₂ + SO₂ + 2H₂O$\xlongequal{}$2HCl + H₂SO₄ 2Fe³⁺ + SO₂ + 2H₂O$\xlongequal{}$2Fe²⁺ + SO₄²⁻ + 4H⁺
查看更多完整答案,请扫码查看


